Einleitung
Bei einer Endothelläsion kommen prothrombotische subendotheliale Gefässbestandteile mit prokoagulanten Prostaglandinen an der Oberfläche in Kontakt und führen zur Aktivierung von Thrombozyten. Diese degranulieren und sezernieren gerinnungsaktive Mikropartikel wie Adenosin-5’-diphosphat (ADP) und Thromboxan A
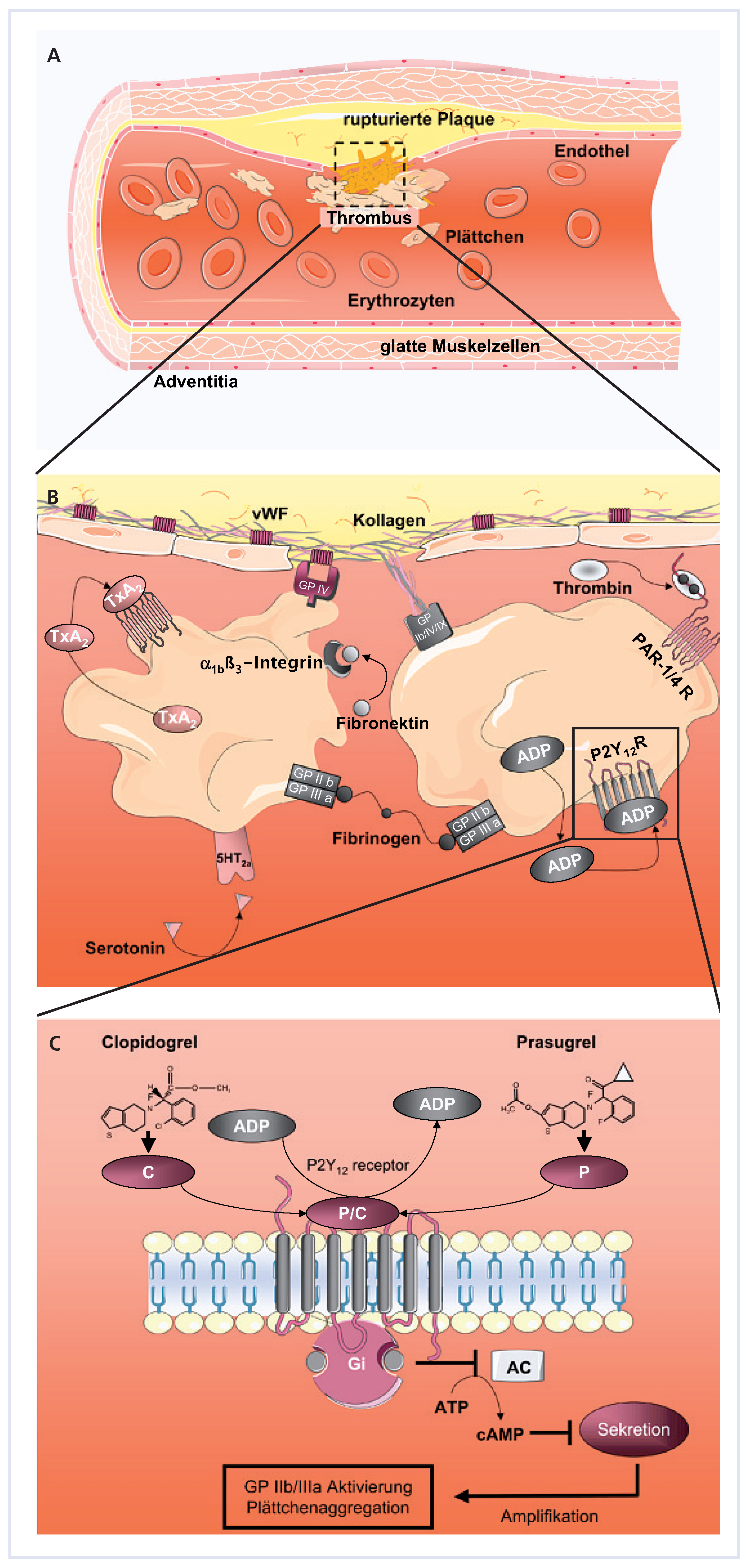
2, die wiederum an ihre Plättchenrezeptoren binden und zur Stimulation der Thrombozyten führen. Die aktivierten Thrombozyten vernetzen sich über zirkulierendes Fibrinogen, was letztlich zur Plättchenaggregation und Bildung eines okkludierenden Thrombus an der Endothelläsion führt. Thienopyridine wie Clopidogrel blockieren selektiv die Bindung von ADP an seine Rezeptoren auf Thrombozyten (Abb. 1) [
1]. Verglichen mit Clopidogrel hat der neue Wirkstoff Prasugrel (CS-747, LY640315), ebenfalls ein Thienopyridin, eine mehr als 10fach höhere Wirksamkeit sowie einen schnelleren Wirkeintritt. Auch das Problem der interindividuellen Variabilität der Clopidogrel-Wirkung, die sogenannten Clopidogrel-«Nonresponder», wurde unter Prasugrel nicht beschrieben [
2]. In der Phase-III-TRITON-TIMI-38-Studie wurde Prasugrel bei Patienten mit Akutem Koronarsyndrom (ACS) vor perkutaner Koronarintervention (PCI) untersucht [
3]. Ziel der vorliegenden Übersichtsarbeit ist es, einen Überblick über die aktuelle Evidenz für den klinischen Einsatz von Prasugrel sowie den Kenntnisstand bezüglich unerwünschter Wirkungen zu geben.
Abbildung 1.
Thrombozyteninteraktionen und Angriffsorte und Wirkprinzip der Thienopyridine. A Fibrinvernetzter Thrombus an Endothelläsion. B Hauptfunktionen der aktivierten Plättchen. Adhäsion mittels Oberflächenglykoproteine an Kollagenfasern, Aggregation mit anderen Thrombozyten durch Brückenbildung mit Fibrinogen. vWF = Von-Willebrand-Faktor; ADP = Adenosin-Diphosphat; GP = Glykoprotein; PAR-1/4 = Thrombinrezeptor; TXA2 = Thromboxan A2. C P2Y12-Rezeptor Angriffsort der Thienopyridine mit Signaltransduktion. P/C = Prasugrel/Clopidogrel; AC = Adenylat-Cyclase; ATP = Adenosin-Triphosphat.
Abbildung 1.
Thrombozyteninteraktionen und Angriffsorte und Wirkprinzip der Thienopyridine. A Fibrinvernetzter Thrombus an Endothelläsion. B Hauptfunktionen der aktivierten Plättchen. Adhäsion mittels Oberflächenglykoproteine an Kollagenfasern, Aggregation mit anderen Thrombozyten durch Brückenbildung mit Fibrinogen. vWF = Von-Willebrand-Faktor; ADP = Adenosin-Diphosphat; GP = Glykoprotein; PAR-1/4 = Thrombinrezeptor; TXA2 = Thromboxan A2. C P2Y12-Rezeptor Angriffsort der Thienopyridine mit Signaltransduktion. P/C = Prasugrel/Clopidogrel; AC = Adenylat-Cyclase; ATP = Adenosin-Triphosphat.
Pharmakokinetisches Profil der Thienopyridine
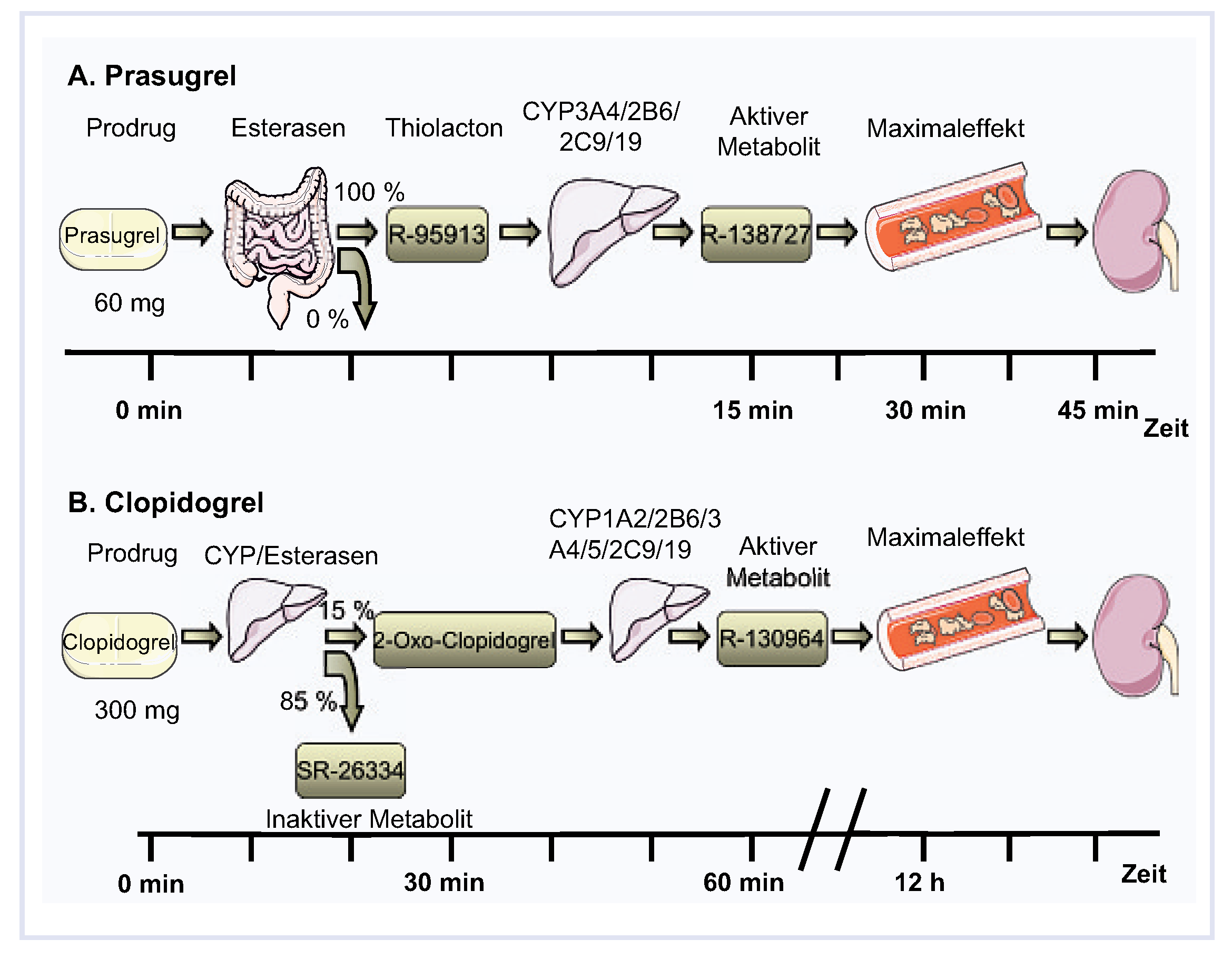
Prasugrel, ein Prodrug, wird vollständig in seinen aktiven Metaboliten konvertiert, während die Umsetzung bei Clopidogrel nur etwa 10–15% beträgt, da ca. 85% einer Clopidogrel-Dosis vor Wirkungseintritt durch Esterasen zum inaktiven Carboxylat-Metaboliten SR 26334 metabolisiert werden (Abb. 2) [
4]. Clopidogrel benötigt für seine Aktivierung zwei Cytochrom-Oxidationsschritte. Im ersten Schritt wird 2-oxo Clopidogrel gebildet, welches dann in einem zweiten Schritt zur aktiven Substanz metabolisiert wird.
In vivo wird Prasugrel nach Hydrolyse der Estergruppe und Öffnung des Thiophenringes durch hepatische und intestinale Cytochrom-P450-Oxidasen [
4] in die eigentliche Wirkform R-138727, ein Thiolacton, überführt und bindet irreversibel an den Plättchen-ADP-Rezeptor P2Y12 [
5]. R-138727 kann bereits 15 Minuten nach Administration im Plasma nachgewiesen werden und erreicht einen Maximalspiegel nach 30 Minuten. Die Prasugrel-Metaboliten werden überwiegend renal ausgeschieden (Abb. 2) [
6]. In-vitro-Studien lassen vermuten, dass die aktiven Prasugrel-Metaboliten den Cytochrom-abhängigen Metabolismus gleichzeitig verabreichter Substanzen nicht beeinflussen [
4,
6]. Der Clopidogrel-/Prasugrel-Effekt richtet sich nach der Lebensdauer der Thrombozyten (ca. 10 Tage). So persistiert eine relevante Hemmung der Plättchenaggregation über 5 Tage [
7].
Abbildung 2.
Siehe Text für Details. A Pharmakokinetisches Profil Prasugrel. B Pharmakokinetisches Profil Clopidogrel. CYP = Cytochrom-Oxidase.
Abbildung 2.
Siehe Text für Details. A Pharmakokinetisches Profil Prasugrel. B Pharmakokinetisches Profil Clopidogrel. CYP = Cytochrom-Oxidase.
Entwicklung von Prasugrel: Phase-I-und Phase-II-Studien
Prasugrel wurde durch «Eli Lilly Co.» und «Sankyo Co.» entwickelt. In mehreren präklinischen und Phase-I-Studien war gezeigt worden, dass Prasugrel (CS-747, LY640315) im Vergleich zu Clopidogrel 10 bis 100fach potenter, schneller im Erreichen der Maximalwirkung und interindividuell konsistenter ist [5,7–9]. Eine Prasugrel-Resistenz wurde nicht beobachtet. Die häufigsten unerwünschten Wirkungen beinhalteten Blutungskomplikationen wie Hämatome und Bagatellblutungen [
10,
11,
12,
13].
Die Phase-II-JUMBO-TIMI-26 (Joint Utilization of Medications to Block Platelets Optimally-Thrombolysis In Myocardial Infarction 26)-Multicenter-Studie demonstrierte einen nichtsignifikanten Trend hin zu einer Reduktion kardiovaskulärer Ereignisse in den Prasugrel-Gruppen bei 904 Patienten vor PCI [
14]. Erstmals imponierten in der Hochdosis-Prasugrel-Gruppe (60 mg Aufsättigungsdosis / 15 mg/Tag) eine signifikant höhere Anzahl leichter Blutungskomplikationen. Eine weitere Phase-II-Studie bei Patienten mit stabiler Koronarsklerose bestätigte diese Daten [
15].
Phase-III-Studie: TRITON-TIMI-38
Die doppelblind randomisierte Multizenterstudie TRITON-TIMI-38 wurde in Zusammenarbeit mit der TIMI-Studiengruppe an der «Harvard Medical School» und am «Brigham and Women’s Hospital» in Boston durchgeführt und rekrutierte international 13608 Patienten mit ACS mässigen bis hohen Risikos, bei denen eine PCI geplant war [
3]. Das Studien-Design ging von der Hypothese aus, Prasugrel sei der Standardmedikation überlegen. Die Patienten wurden, zusätzlich zu Azetylsalizylsäure, entweder mit Prasugrel (60 mg Aufsättigungsdosis / 10 mg/d) oder Clopidogrel (300 mg Aufsättigungsdosis / 75 mg/Tag) behandelt. Ausgeschlossen wurden Patienten mit erhöhtem Blutungsrisiko, Anämie, Thrombozytopenie oder früheren intrakraniellen Blutungen. Die Behandlungsdauer betrug 6–15 Monate. Primärer Endpunkt war eine Kombination aus dem Auftreten von kardiovaskulärem Tod, nicht tödlichem Myokardinfarkt und nicht tödlicher zerebrovaskulärer Ischämie (Abb. 3). Die ersten Analysen dieser Studie wurden im November 2007 veröffentlicht [
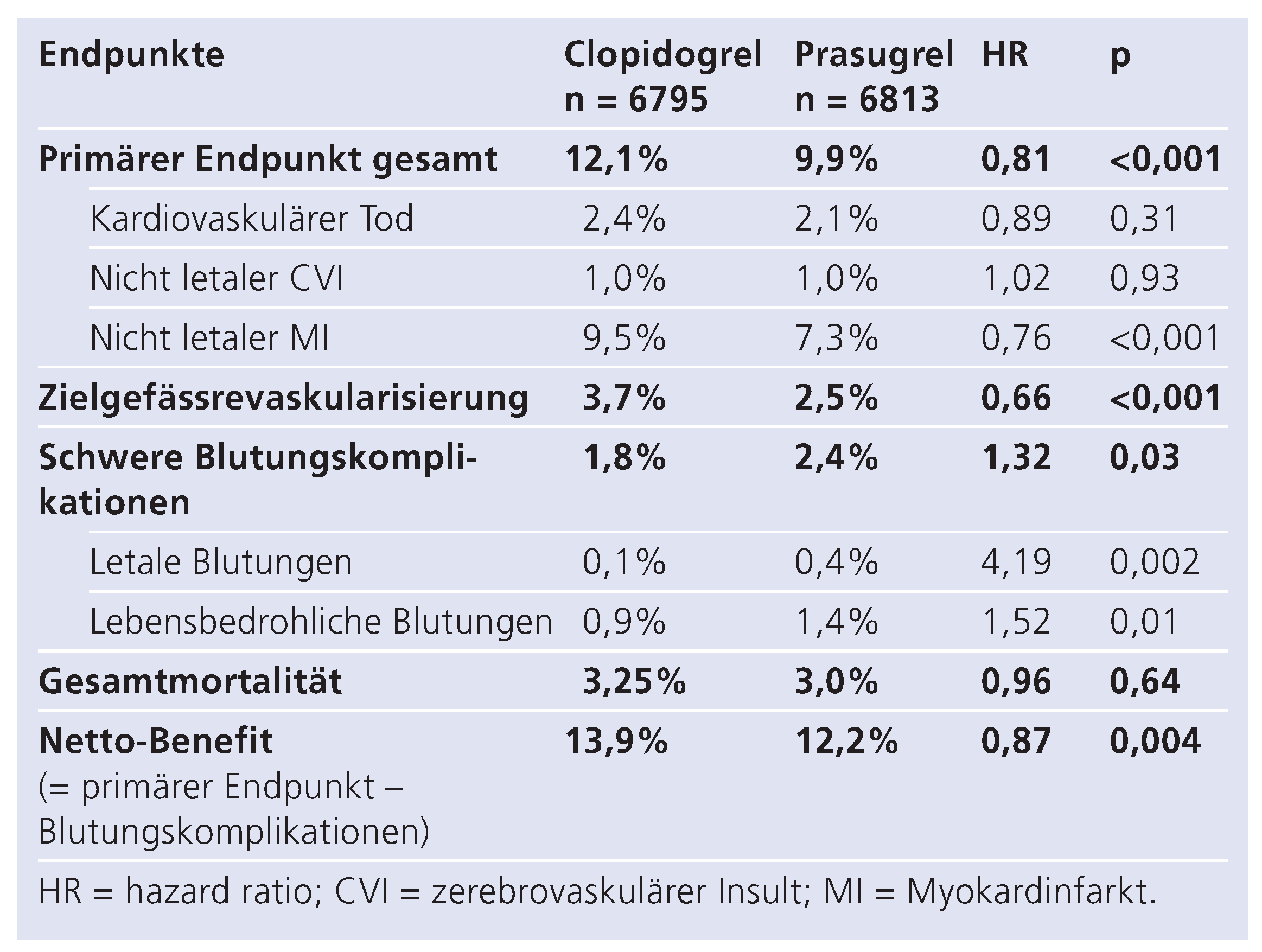
3]. Hierbei konnte eine Reduktion des primären Endpunktes in der Prasugrel-Gruppe demonstriert werden (9,9% vs. 12,1%; Hazard Ratio (HR) 0,81; p = 0,0004) unter Inkaufnahme vermehrter Blutungen bei gleicher Mortalität.
Abbildung 3.
Studiendesign der TRITON-TIMI-Studie, schematische Darstellung.
Abbildung 3.
Studiendesign der TRITON-TIMI-Studie, schematische Darstellung.
Das bedeutete eine Risikoreduktion gegenüber Clopidogrel um signifikante 19% und bestätigte die Ausgangshypothese der Superiorität (Tab. 1). Der Vorteil für Prasugrel zeigte sich schon im ersten präspezifizierten Kontrollpunkt drei Tage nach der PCI (5,6% unter Clopidogrel, 4,7% unter Prasugrel). Dieser Unterschied blieb während der nachfolgenden Follow-up-Periode erhalten. Im Detail reduzierte sich die Rate der Myokardinfarkte von 9,5% in der Clopidogrel-Gruppe auf 7,3% in der Prasugrel-Gruppe (HR 0,76; p <0,001). Die Notwendigkeit einer Revaskularisierung des Infarktgefässes sank von 3,7% in der Clopidogrel-Gruppe auf 2,5% in der Prasugrel-Gruppe (HR 0,66; p <0,001), jedoch ohne sich signifikant auf die Gesamtmortalität (3,0% vs. 3,2% unter Clopidogrel) oder die kardiale Mortalität (2,1% vs. 2,4%) auszuwirken [
3]. Auch zeigte sich in der Prasugrel-Gruppe eine Reduktion von Zweitereignissen nach stattgehabtem Eintritt des primären Endpunktes (15,4% unter Clopidogrel, 10,8% unter Prasugrel) [
16].
Table 1.
TRITON-TIMI-38-Studie: Primäre Endpunkte und Inzidenz der Blutungskomplikationen in beiden Gruppen.
Table 1.
TRITON-TIMI-38-Studie: Primäre Endpunkte und Inzidenz der Blutungskomplikationen in beiden Gruppen.
Schwere Blutungskomplikationen wurden in 2,4% der Prasugrel-behandelten Patienten beobachtet, während nur 1,8% in der Clopidogrel-Gruppe betroffen waren. Ebenso war die Rate lebensbedrohlicher (1,4% vs. 0,9%, HR 1,52; p <0,01) bzw. tödlicher Blutungen (0,4% vs. 0,1%; HR 4,19; p <0,002) in der Prasugrel-Gruppe erhöht. Hiervon betroffen waren vor allem Patienten mit einer Schlaganfall- oder transitorischen ischämischen Attacke (TIA)-Anamnese, Patienten über 75 Jahre und Patienten mit einem Gewicht unter 60 kg (Tab. 2) [
3]. Die Abwägung von Nutzen und Risiko favorisierte dennoch die neuere Substanz, da das Gesamtrisiko, berechnet als primärer Endpunkt abzüglich der Blutungskomplikationen, in der Prasugrel-Gruppe gegenüber der Clopidogrel-Gruppe um 13% reduziert war (p = 0,004).
Table 2.
Vergleich der Risikoreduktion des primären Endpunktes durch Prasugrel und Clopidogrel in Subgruppen der TRITON-TIMI-38-Studie.
Table 2.
Vergleich der Risikoreduktion des primären Endpunktes durch Prasugrel und Clopidogrel in Subgruppen der TRITON-TIMI-38-Studie.
Subgruppen-Analysen der TRITON-TIMI-38-Studie
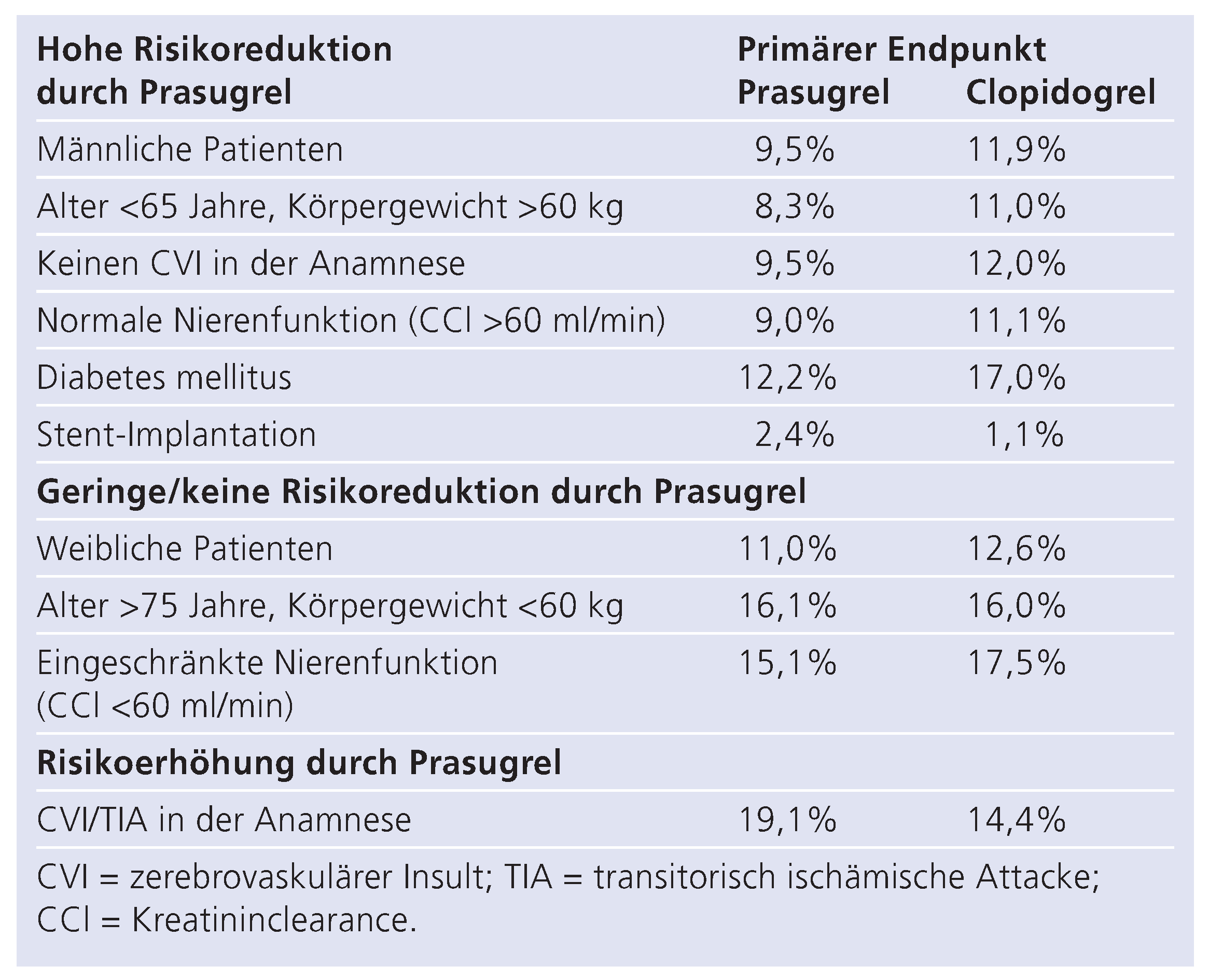
Bemerkenswert ist eine Reduktion des kombinierten Endpunktes unter Prasugrel bei Diabetikern, einer Gruppe von 3146 Patienten (12,2% vs. 17%; relative Risikoreduktion 30%) bei gleicher Rate an Blutungskomplikationen (2,6% unter Clopidogrel vs. 2,5% unter Prasugrel) [
17]
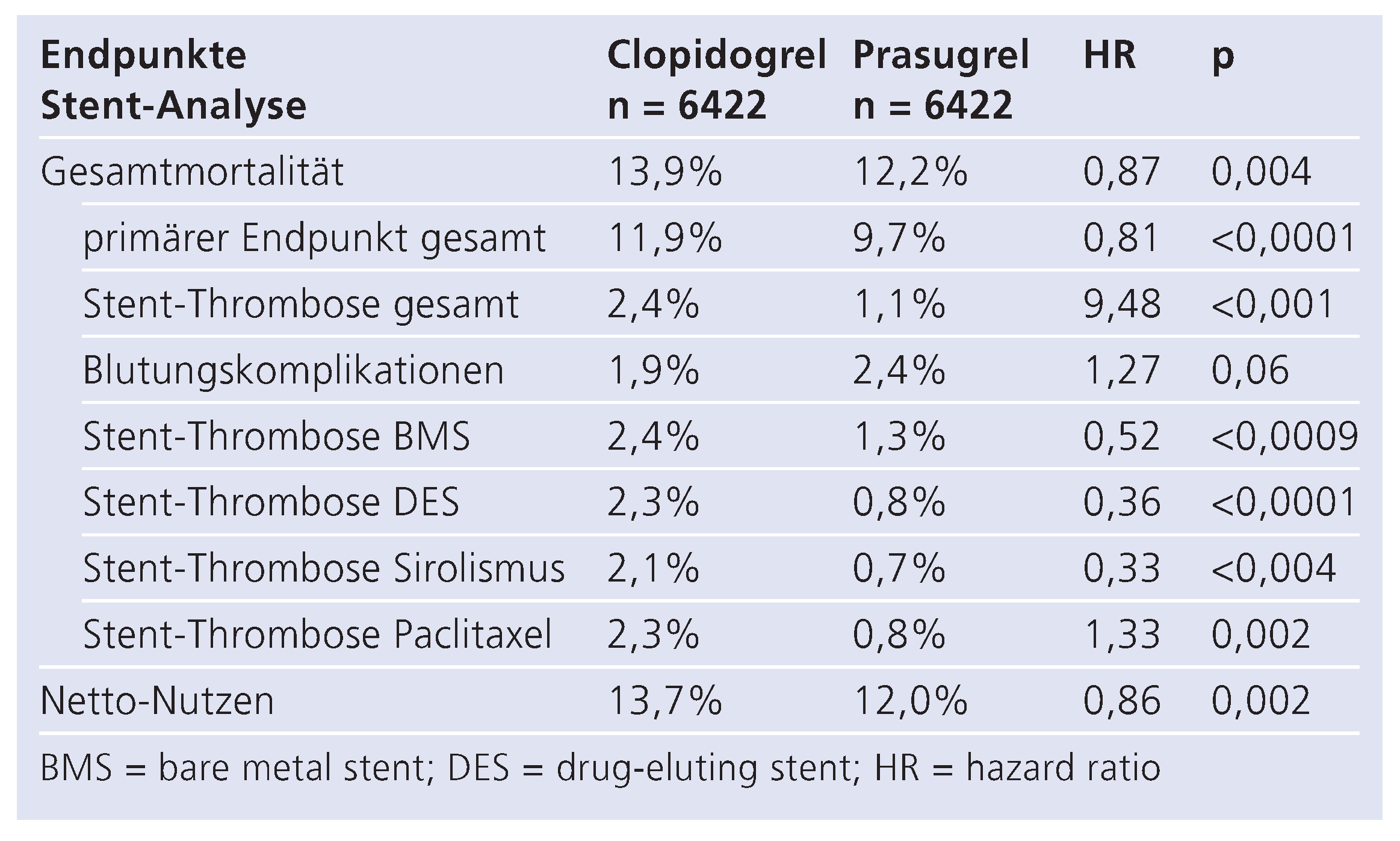
. Des Weiteren profitierten Patienten unter 65 Jahren und einem Körpergewicht über 60 kg (8,3% vs. 11%) sowie männliche Patienten (9,5% vs. 11,9%) von der Prasugrel-Gabe, wohingegen sich bei über 75-jährigen Patienten mit einem Körpergewicht <60 kg nur eine geringe bzw. keine Risikoreduktion zeigte (Tab. 2). Die am meisten gefürchtete Komplikation nach koronarer Stent-Implantation ist die Stent-Thrombose. Diesbezüglich konnte die TRITON-TIMI-Studie eine Reduktion von Stent-Thrombosen durch Prasugrel um 52% (1,1 vs. 2,4%; p <0,001) in einer Subpopulation von 12 844 Patienten (entspricht 94% der Studienpopulation) demonstrieren (Tab. 3, Abb. 4) [
18]. Dies galt sowohl für unbeschichtete (48%) als auch für beschichtete Stents (64%), ebenso wie für frühe (59%) als auch für späte Stent-Thrombosen (40%). Innerhalb der Gruppe der beschichteten Stents fand sich kein Unterschied (Paclitaxel-Stent 0,8% vs. 2,3%; p = 0,002; Sirolimus-Stent 0,7% v. 2,1%; p = 0,004). Die Prasugrel-Gabe war zwar mit einer erhöhten Anzahl von Blutungen assoziiert, jedoch nicht mit einer erhöhten blutungsbedingten Mortalität. Zusammenfassend konnte ein Benefit der Prasugrel-Gabe bei der Prävention der Stent-Thrombose demonstriert werden, unabhängig vom Zeitpunkt der Stent-Thrombose oder unterschiedlichen Academic Research Consortium (ARC)-Definitionen. Prasugrel schien die grösste Wirkung bei Patienten mit Bifurkationsstents, eingeschränkter Nierenfunktion oder Diabetes mellitus zu entfalten.
Table 3.
Ergebnisse der Stent-Analyse der TRITON-TIMI-38-Studie: primäre Endpunkte und Inzidenz der Stent-Thrombosen im Vergleich.
Table 3.
Ergebnisse der Stent-Analyse der TRITON-TIMI-38-Studie: primäre Endpunkte und Inzidenz der Stent-Thrombosen im Vergleich.
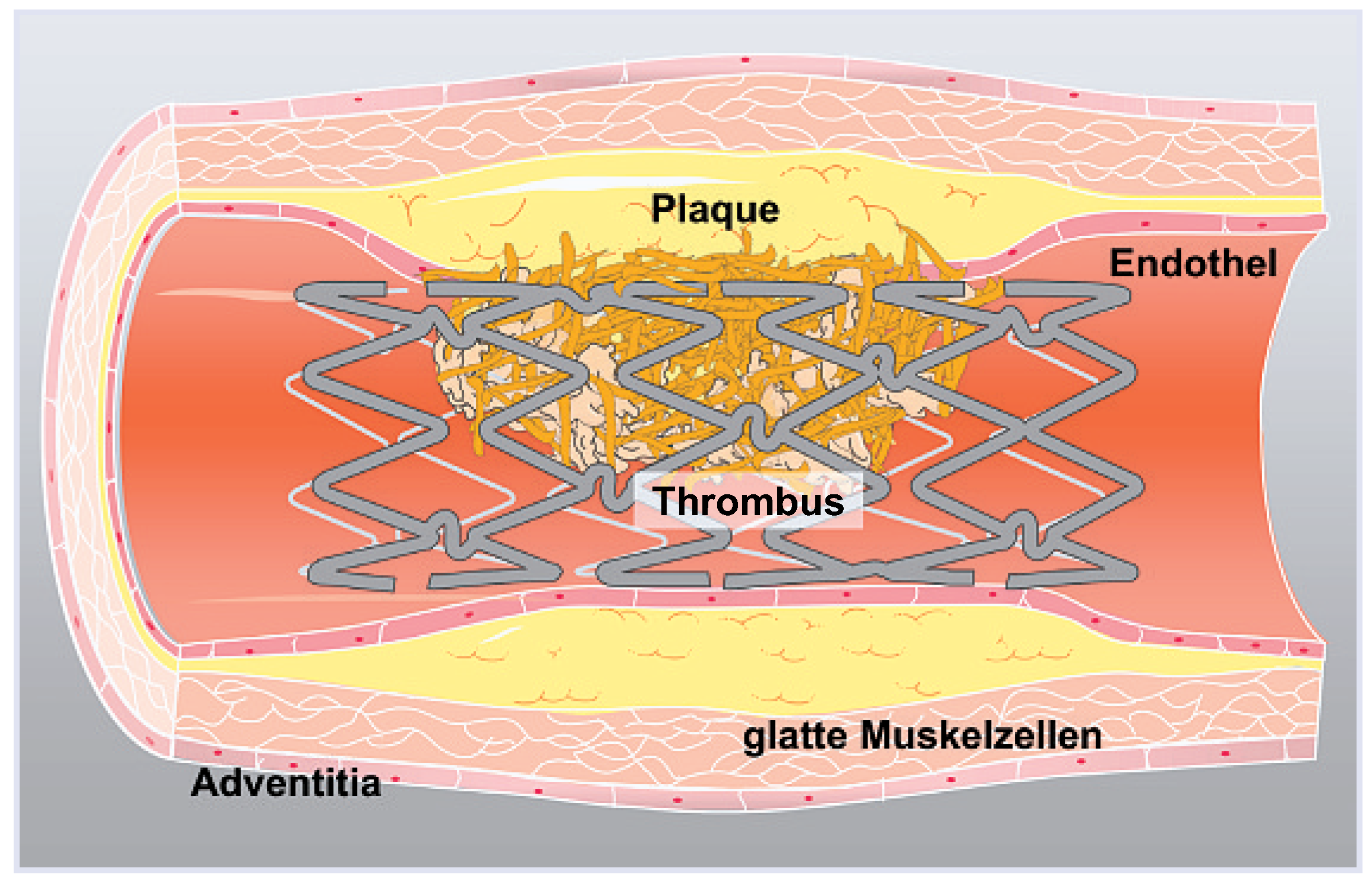
Abbildung 4.
Stent-Thrombose mit fibrinvernetztem Thrombus an der Endothelläsion.
Abbildung 4.
Stent-Thrombose mit fibrinvernetztem Thrombus an der Endothelläsion.
Prasugrel im Vergleich mit Hochdosis-Clopidogrel
Für Clopidogrel wird die Möglichkeit einer Wirkungssteigerung durch Verdoppelung der Aufsättigungsdosis diskutiert, der klinische Nutzen der Dosisverdoppelung ist jedoch noch nicht eindeutig belegt. Eine limitierte Anzahl von Wirksamkeitsstudien zur Hochdosis-Clopidogrel-Therapie konnte im Vergleich mit der Standarddosierung (300 mg) einen potenteren Effekt der 600-mg-Dosis auf die Plättchenhemmung sowie einen schnelleren Wirkeintritt zeigen [19, 20]. Allerdings wurden auch bei höherer Clopidogrel-Dosierung die Existenz von «non-responders» beschrieben [
21]
. Die derzeit laufende OASIS-7 (Optimal Antiplatelet Strategy for InterventionS)-Studie ist die erste randomisierte Prospektivstudie mit ausreichend Power, die einen möglichen Vorteil der 600-mg Aufsättigungsdosis, gefolgt von einer 150-mg-Dosis über 7 Tage gegenüber der 300/75-mg-Dosierung bei 14 000 Patienten mit ACS vor PCI analysiert. Die PRINCIPLE-TIMI-44 (Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44)-Studie, eine randomisierte, doppelblinde Cross-over-Studie, untersuchte den Effekt einer Hochdosis-Therapie mit Clopidogrel (600 mg/150 mg) verglichen mit Prasugrel (60 mg/ 10 mg) bei 201 Patienten vor geplanter Koronarangiographie über 28 Tage und demonstrierte eine signifikant stärkere und schneller einsetzende Plättcheninhibierung in der Prasugrel-Gruppe (61,3% vs. 46,1%; p <0,0001), bei gleicher Anzahl von Blutungskomplikationen in beiden Gruppen [
22]
. Drei weitere unabhängige Studien in unterschiedlichen Populationen konnten diese Ergebnisse bestätigen [15, 23, 24]. Diskussion
Der Zusammenhang zwischen antithrombotischer Therapie, Blutungen und ischämischen Ereignissen ist extrem komplex und wird erst schrittweise aufgedeckt. Die TRITON-TIMI-38-Studie hat hierzu einen grossen Beitrag geleistet. Angesichts der Ergebnisse ist Prasugrel für Leitautor Elliott Antman ein «zulassungsfähiges» Medikament. Auch wenn die Entscheidung hierfür den Zulassungsbehörden FDA (Food and Drug Administration) und EMEA (Europe, the Middle East and Africa) vorbehalten bleiben wird, äussern sich auch andere Experten zuversichtlich, dass Prasugrel demnächst zugelassen wird. Zusammenfassend scheint ein Nettogewinn von relativen 13% für Prasugrel übrigzubleiben – bei einer Abnahme des absoluten Risikos von 1,7% und gleichbleibender Gesamtmortalität. In seinem begleitenden Editorial zur Originalveröffentlichung schliesst Deepak Bhatt hieraus, dass Prasugrel für Patienten mit akutem Koronarsyndrom, hohem Risiko für ischämische Ereignisse und niedrigem Blutungsrisiko von Nutzen sei, während Patienten mit niedrigem ischämischem Risiko und hohem Blutungsrisiko von Clopidogrel profitieren dürften.
Kritikpunkte
Trotz vielversprechender Ergebnisse bleibt generell am Studiendesign zu kritisieren, dass sich durch die Verwendung der suboptimalen 300-mg-Dosis ein Nachteil für Clopidogrel ergab, auch wenn erst kürzlich die PRINCIPLE-TIMI-44-Studie zeigen konnte, dass auch die Verwendung einer Hochdosis-Clopidogrel-Therapie eine weitaus geringere Plättchenhemmung bewirkt als die Gabe von 60 mg Prasugrel [
22]
. Aufgrund der Daten der PCI-CURE- und der CREDO (Clopidogrel for the Reduction of Events Durings Observation)-Studie besteht jedoch allgemeine Übereinstimmung, dass Clopidogrel umso wirksamer ist, je früher die Substanz zum Einsatz kommt, zudem profitieren Hochrisikokollektive besonders von einer frühen Clopidogrel-Gabe. Bei der TRITON-TIMI-Studie entstand zum einen durch den verzögerten Wirkeintritt der niedrigen Clopidogrel-Aufsättigungsdosis als auch durch die späte Gabe am Kathetertisch ein Vorteil für Prasugrel. Nur eine Minderheit der Studienpopulation erhielt die Aufsättigungsdosis vor der Koronarintervention, während 75% der Patienten während bzw. nach PCI therapiert wurden. Des Weiteren gab es durch die Notwendigkeit der Kenntnis der Koronarmorphologie vor Randomisierung eine gewisse Präselektion des Patientengutes. Die Autoren begegnen dieser Kritik mit dem Argument, dass die Endpunkte in beiden Gruppen innerhalb der ersten 24 Stunden gleich häufig eintraten. Berücksichtigt man den um 6–8 Stunden verspäteten Wirkeintritt von Clopidogrel, scheinen die pharmakokinetischen Profile der beiden Substanzen für die später beobachteten Unterschiede nicht verantwortlich zu sein. Subgruppen
Im Rahmen der Studie wurden vier Subgruppen von Patienten identifiziert, die unter beiden Medikationen ein höheres Risiko für schwere Blutungen aufweisen: Patienten im Alter von 75 Jahren oder älter, Patienten mit einem Gewicht <60 kg und Patienten, die bereits eine TIA oder einen zerebralen Insult erlitten hatten und Patienten mit eingeschränkter Nierenfunktion. Demgegenüber konnte gezeigt werden, dass Prasugrel bei Diabetikern zu einer relativen Risikoreduktion von 30% führte. Im Detail reduzierte Prasugrel das Risiko eines Reinfarktes bei Diabetikern um 40% versus 18% bei Nicht-Diabetikern. Auffallend ist zudem, dass keine erhöhte Rate an Blutungskomplikationen in der Prasugrel-Gruppe nachweisbar war [
17]
. Somit lassen diese Daten eine sichere Überlegenheit von Prasugrel in dieser Hochrisikopopulation erkennen. Vor einem routinemässigen Einsatz von Prasugrel bei Diabetikern sollte diese Subpopulation jedoch mittels einer grösseren Kohortenstudie untersucht werden. Auch bleibt zu untersuchen, ob der Verzicht auf die Gabe von Glykopeptid-IIb/IIIa-Antagonisten, die immerhin über die Hälfte der Diabetiker in der TRITON-TIMIStudie zusätzlich zur Studienmedikation eingenommen haben, das Sicherheitsprofil von Prasugrel in dieser Population verbessern kann. Bemerkenswert ist ebenfalls eine Risikoreduktion bei der selten auftretenden, jedoch häufig fatalen Stent-Thrombose um 52%. In der Stent-Analyse war Prasugrel mit einer erhöhten Anzahl von Blutungen assoziiert, jedoch nicht mit einer erhöhten blutungsbedingten Mortalität. Leider wurden die Prasugrel-assoziierten Blutungskomplikationen in dieser Substudie sehr heterogen definiert, so dass die Berechnung eines Nettogewinns durch Prasugrel nicht möglich ist. Die höchste Risikoreduktion wurde bei der frühen Stent-Thrombose beobachtet. Auffallend ist ebenfalls die niedrige Rate an Stent-Thrombosen bei beschichteten Stents, trotz deren Einsatz in Hochrisikoläsionen.
Unerwünschte Wirkungen
Verglichen mit früheren Studien wurden bei der TRITON-TIMI-38-Studie auch ältere Patienten und Patienten mit leichtgradiger Niereninsuffizienz eingeschlossen, was die höhere Komplikationsrate erklären könnte. Allerdings muss bedacht werden, dass Patienten mit erhöhtem Blutungsrisiko bei der Randomisierung ausgeschlossen wurden. Trotzdem wurden in der Prasugrel-Gruppe signifikant häufiger schwere Blutungen (2,4% vs. 1,8%), spontane Blutungen (1,6% vs. 1,1%) und transfusionsbedürftige Blutungen (4% vs. 3%) beobachtet. Folglich ist abzuwarten, ob Prasugrel auch unter Alltagsbedingungen Clopidogrel überlegen sein wird. Mittelschwere Blutungskomplikationen wie Hämaturie, Hämatemesis oder ein Hämoglobin-Abfall um 3 g/dl, die im klinischen Alltag oftmals wegweisend sind, wurden in der TRITON-TIMI-Studie nicht differenziert.
Bislang liegt keine Evidenz vor, ob nicht bei mittel- bis langfristiger Gabe höhere Dosen Clopidogrel sicherer und ähnlich effizient wie Prasugrel wirken. Die PRINCIPLE-TIMI-44-Studie bringt diesbezüglich, aufgrund der kurzen Follow-up-Zeit, keine Erkenntnis. Eine Zusammenschau der Daten der JUMBO-26-, PRINCIPLE-TIMI-44- und der TRITON-TIMI-38-Studien lässt vermuten, dass sich die Mehrheit schwerer Blutungskomplikationen >30 Tage nach Gabe der Erstdosis ereignen. Unter Berücksichtigung der aktuellen Guidelines, die eine 12-monatige Thienopyridin-Therapie nach perkutaner Koronarintervention empfehlen, erscheint ein Einsatz von Prasugrel in einem langfristigen Setup bedenklich. Gegenstand zukünftiger Studien sollte zudem eine mögliche Dosisreduktion der Prasugrel-Gabe, eine Monotherapie mit Prasugrel ohne Azetylsalizylsäure oder eine kurzfristige Prasugrel-Therapie (<30 Tagen) bei Hochrisikopatienten mit folgender Clopidogrel-Gabe sein, um das Blutungsrisiko zu minimieren.
Synthese und Ausblick
Zukünftige Forschung wird auf eine individuelle antiaggregatorische Therapie fokussieren müssen. Hierbei gilt es, die Therapie im Hinblick auf die in der TRITON-TIMI-38-Studie demonstrierten Risikogruppen individuell anzupassen. Es scheint, dass das «one-sizefits-it-all»-Konzept nicht länger bei der Optimierung der antiaggregatorischen Therapie gültig ist. Vermutlich wird der Analyse der Plättchenaktivität, die ein guter Indikator für spätere thrombembolische Ereignisse zu sein scheint [
25]
, in der Zukunft eine Rolle bei der Therapieentscheidung zukommen. Hierdurch kann die Therapie individuell, unter Abwägung des Risikos eines thromboembolischen Ereignisses einerseits und des Blutungsrisikos andererseits, angepasst werden, und die Endpunkte mit aggressiveren Methoden wahrscheinlich verbessert werden. Allerdings sind die Labortests aufgrund der schwierigen Standardisierung gegenwärtig noch nicht zur praktischen Anwendung zu empfehlen. Aktuell werden in der TRILOGY-ACS (Targeted Platelet Inhibition to Clarify the Optimal Strategy to Medically Manage Acute Coronary Syndromes)-Studie, einer pharmakokinetischen Substudie, weitere Subgruppen-Analysen der TRITON-TIMI-38-Studie durchgeführt, um die Dosismodifikation in bestimmten Subgruppen zu untersuchen. Des Weiteren bleibt zu klären, ob nicht einem kurz wirksamen Thienopyridin bei der Prävention periprozeduraler Ereignisse der Vorzug gegeben werden sollte. Cangrelor und AZD 6140, reversible kurzwirksame ADP-Rezeptor-Antagonisten, zeigen ebenfalls eine effektive und sichere Plättchenhemmung bei PCI-Patienten [26, 27]. Der schnelle Wirkeintritt und Wirkungsverlust machen diese Substanzen attraktiv für Kandidaten einer Bypass-Operation.