Rauchen und Kardiovaskuläre Erkrankungen
Summary
Einleitung
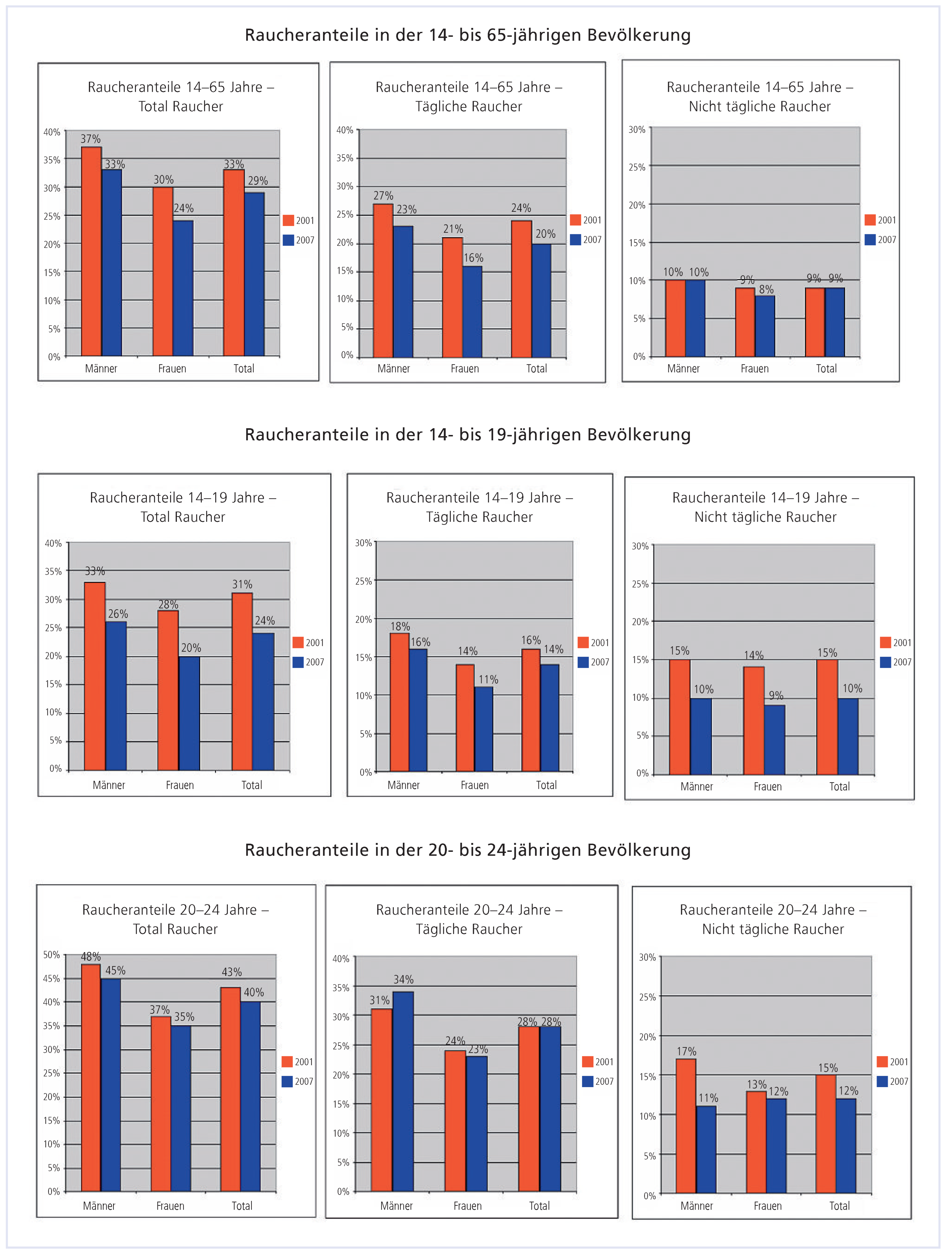
Zahlen zum Tabakkonsum in der Schweiz
Rauchen als Kardiovaskulärer Risikofaktor
Pathophysiologische Effekte des Rauchens auf das Kardiovaskuläre System
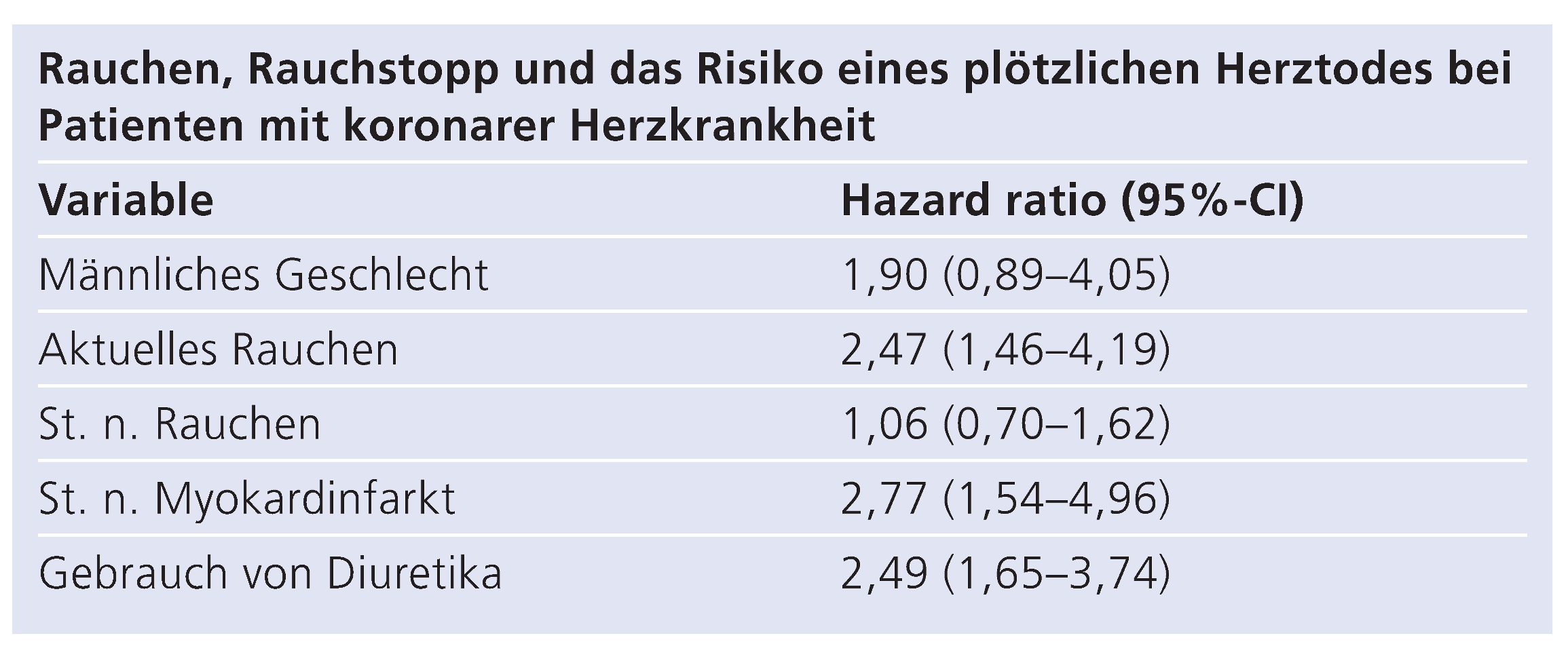
Rauchen in Spezifischen Kardialen Situationen und Nach Kardiovaskulären Interventionen
Auswirkungen Eines Rauchstopps auf das Kardiovaskuläre Risiko
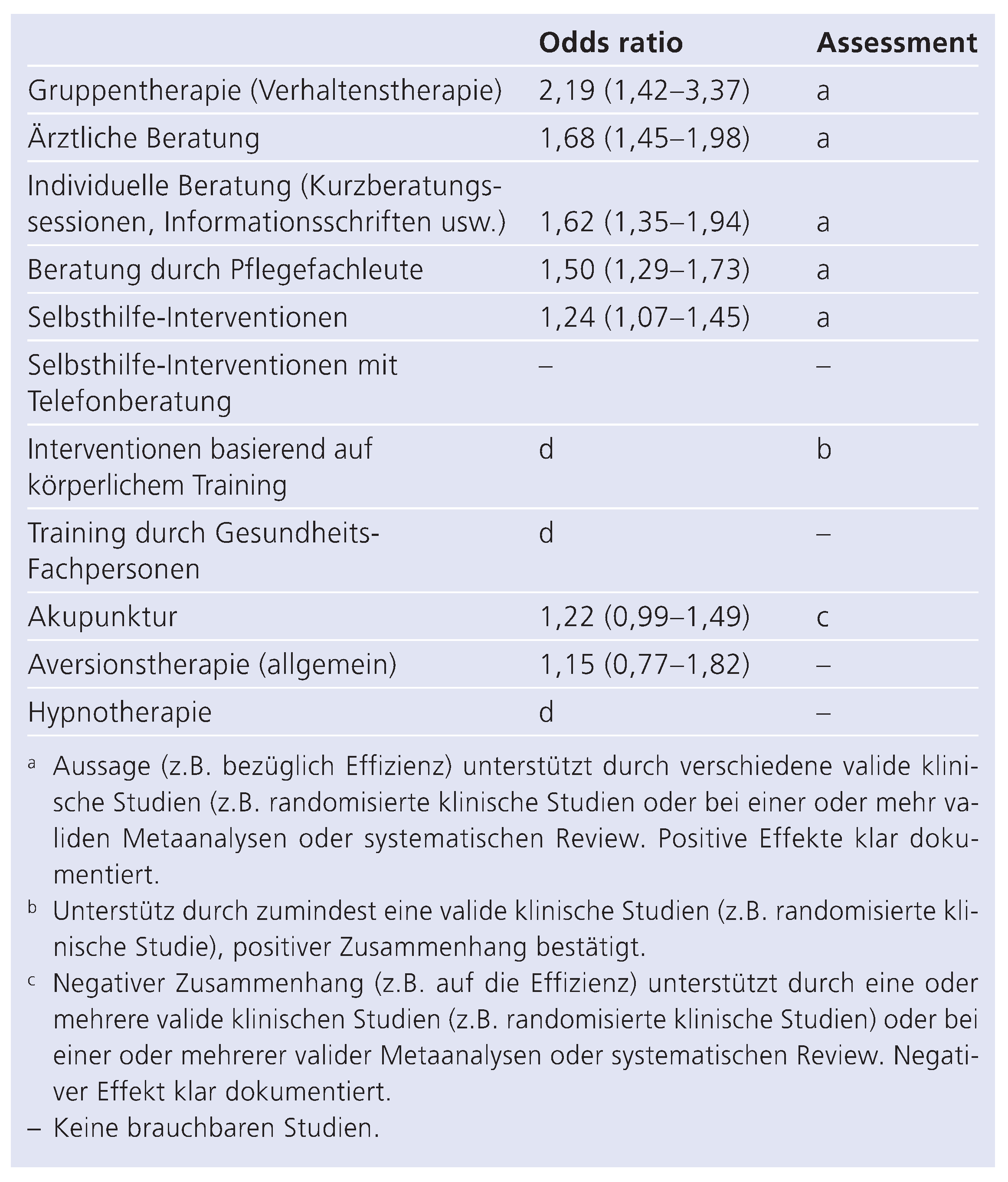
Interventionen zur Unterstützung des Rauchstopps
Schlussfolgerungen
Conflicts of Interest
References
- Keller, et al. Tabakmonitoring. Jahresbericht 2007. Stand Mai 2008. 2008.
- Reid, D.D.; Hamilton, P.J.; McCartney, P.; Rose, G.; Jarrett, R.J.; Keen, H. Smoking and other risk factors for coronary heart disease in British civil servants. Lancet 1976, 2, 979–984. [Google Scholar] [CrossRef]
- Doll, R.; Peto, R.; Wheatley, K.; Gray, R.; Sutherland, I. Mortality in relation to smoking: 40 years’ observation on male British doctors. BMJ 1994, 309, 901–911. [Google Scholar] [CrossRef]
- Kannel, W.B.; Mc Gee, D.L.; Catelli, W.P. Latest perspectives on cigarette smoking and cardiovascular disease: the Framingham experience. J Cardiac Rehab. 2000, 4, 267–277. [Google Scholar]
- Yusuf, S.; Hawken, S.; Ounpuu, S.; Dans, T.; Avezum, A.; Lanas, F.; INTERHEART Study Investigators; et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004, 364, 937–952. [Google Scholar] [CrossRef]
- Doll, R.; Peto, R.; Wheatley, K.; Gray, R.; Sutherland, I. Mortality in relation to smoking: 50 years’ observation on male British doctors. BMJ 2004, 328, 1529–1537. [Google Scholar] [CrossRef]
- Conroy, R.M.; Pyörälä, K.; Fitzgerald, A.P.; on behalf of the SCORE project group; et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J. 2003, 24, 987–1003. [Google Scholar] [CrossRef]
- Doll, R.; Peto, R. Mortality in relation to smoking: 20 years’ observations on male British doctors. BMJ 1976, 2, 1525–1536. [Google Scholar] [CrossRef]
- Barua, R.S.; Ambrose, J.A.; Eales-Reynolds, L.J.; DeVoe, M.C.; Zervas, J.G.; Saha, D.C. Heavy and light cigarette smokers have similar dysfunction of endothelial vasoregulatory activity: an in vivo and in vitro correlation. J Am Coll Cardiol. 2002, 39, 1758–1763. [Google Scholar] [CrossRef] [PubMed]
- Wolk, R.; Shamsuzzaman, A.S.; Svatikova, A.; Huyber, C.M.; Huck, C.; Narkiewicz, K.; et al. Hemodynamic and autonomic effects of smokeless tobacco in healthy young men. J Am Coll Cardiol. 2005, 45, 910–914. [Google Scholar] [CrossRef] [PubMed]
- Bjartveit, K.; Tverdal, A. Health consequences of smoking 1–4 cigarettes per day. J Tobacco Control 2005, 14, 315–320. [Google Scholar] [CrossRef] [PubMed]
- Keil, U.; Liese, A.D.; Hense, H.W.; et al. Classical risk factors and their impact on incident non-fatal and fatal myocardial infarction and all-cause mortality in southern Germany. Results from the MONICAAugsburg cohort study 1984– 1992. Eur Heart J. 1998, 19, 1197–207. [Google Scholar] [CrossRef]
- Sinha, S.; Luben, R.N.; Welch, A.; Bingham, S.; Wareham, N.J.; Day, N.E.; et al. Fibrinogen and cigarette smoking in men and women in the European Prospective Investigation into Cancer in Norfolk (EPIC-Norfolk) population. Eur J Cardiovasc Prev Rehabil. 2005, 12, 144–150. [Google Scholar] [CrossRef] [PubMed]
- Fisher, S.D.; Zareba, W.; Moss, A.J.; Marder, V.J.; Sparks, C.E.; Hochman, J.; THROMBO Investigators; et al. Effect of smoking on lipid and thrombogenic factors two months after acute myocardial infarction. Am J Cardiol. 2000, 86, 813–818. [Google Scholar] [CrossRef] [PubMed]
- O’Callaghan, P.A.; Fitzgerald, A.; Fogarty, J.; Gaffney, P.; Hanbidge, M.; Boran, G.; et al. New and old cardiovascular risk factors: C-reactive protein, homocysteine, cysteine and von Willebrand factor increase risk, especially in smokers. Eur J Cardiovasc Prev Rehabil. 2005, 12, 542–547. [Google Scholar] [CrossRef]
- McVeigh, G.E.; Lemay, L.; Morgan, D.; Cohn, J.N. Effects of long-term cigarette smoking on endothelium-dependent responses in humans. Am J Cardiol. 1996, 78, 668–672. [Google Scholar] [CrossRef]
- Neunteufl, T.; Heher, S.; Kostner, K.; Mitulovic, G.; Lehr, S.; Khoschsorur, G.; et al. Contribution of nicotine to acute endothelial dysfunction in long-term smokers. J Am Coll Cardiol. 2002, 39, 251–256. [Google Scholar] [CrossRef]
- Blann, A.D.; Kirkpatrick, U.; Devine, C.; Naser, S.; McCollum, C.N. The influence of acute smoking on leucocytes, platelets and the endothelium. Blood Coagul Fibrinolysis. 1998, 9, 479–484. [Google Scholar] [CrossRef]
- Karatzi, K.; Papamichael, C.; Karatzis, E.; Papaioannou, T.G.; Stamatelopoulos, K.; Zakopoulos, N.A.; et al. Acute smoke-induced endothelial dysfunction is more prolonged in smokers than in non-smokers. Am J Cardiol. 2006, 98, 1424–1428. [Google Scholar] [CrossRef] [PubMed]
- Lavi, S.; Prasad, A.; Yang, E.H.; Mathew, V.; Simari, R.D.; Rihal, C.S.; et al. Smoking is associated with epicardial coronary endothelial dysfunction and elevated white blood cell count in patients with chest pain and early coronary artery disease. Circulation 2007, 115, 2621–2627. [Google Scholar] [CrossRef]
- Newby, D.E.; Wright, R.A.; Labinjoh, C.; Ludlam, C.A.; Fox, K.A.; Boon, N.A.; et al. Endothelial dysfunction, impaired endogenous fibrinolysis, and cigarette smoking: a mechanism for arterial thrombosis and myocardial infarction. Circulation 1999, 99, 1411–1415. [Google Scholar] [CrossRef]
- Rocchi, E.; Bursi, F.; Ventura, P.; Ronzoni, A.; Gozzi, C.; Casalgrandi, G.; et al. Antiand pro-oxidant factors and endothelial dysfunction in chronic cigarette smokers with coronary heart disease. Eur J Intern Med. 2007, 18, 314–320. [Google Scholar] [CrossRef]
- Heiss, C.; Kleinbongard, P.; Dejam, A.; Perré, S.; Schroeter, H.; Sies, H.; et al. Acute consumption of flavanol-rich cocoa and the reversal of endothelial dysfunction in smokers. J Am Coll Cardiol. 2005, 46, 1276–1283. [Google Scholar] [CrossRef] [PubMed]
- Hermann, F.; Spieker, L.E.; Ruschitzka, F.; Sudano, I.; Hermann, M.; Binggeli, C.; et al. Dark chocolate improves endothelial and platelet function. Heart 2006, 92, 119–120. [Google Scholar] [CrossRef]
- Amir, Z.; Mahmud, A.; Feely, J. Acute haemodynamic effects of cigarette smoking in healthy young subjects. Ir J Med Sci. 2006, 175, 20–23. [Google Scholar] [CrossRef]
- Benowitz, N.L.; Sharp, D.S. Inverse relation between serum cotinine concentration and blood pressure in cigarette smokers. Circulation. 1989, 80, 1309–1312. [Google Scholar] [CrossRef]
- Bernaards, C.M.; Twisk, J.W.; Van Mechelen, W.; Snel, J.; Kemper, H.C. A longitudinal study on smoking in relationship to fitness and heart rate response. Med Sci Sports Exerc. 2003, 35, 793–800. [Google Scholar] [CrossRef]
- Minami, J.; Ishimitsu, T.; Matsuoka, H. Effects of smoking cessation on blood pressure and heart rate variability in habitual smokers. Hypertension. 1999, 33, 586–590. [Google Scholar] [CrossRef]
- Vlachopoulos, C.; Kosmopoulou, F.; Panagiotakos, D.; Ioakeimidis, N.; Alexopoulos, N.; Pitsavos, C.; et al. Smoking and caffeine have a synergistic detrimental effect on aortic stiffness and wave reflections. J Am Coll Cardiol. 2004, 44, 1911–1917. [Google Scholar] [CrossRef][Green Version]
- Rehill, N.; Beck, C.R.; Yeo, K.R.; Yeo, W.W. The effect of chronic tobacco smoking on arterial stiffness. Br J Clin Pharmacol. 2006, 61, 767–773. [Google Scholar] [CrossRef] [PubMed]
- Jatoi, N.A.; Jerrard-Dunne, P.; Feely, J.; Mahmud, A. Impact of smoking and smoking cessation on arterial stiffness and aortic wave reflection in hypertension. Hypertension 2007, 49, 981–985. [Google Scholar] [CrossRef] [PubMed]
- Vlachopoulos, C.; Alexopoulos, N.; Panagiotakos, D.; O’Rourke, M.F.; Stefanadis, C. Cigar smoking has an acute detrimental effect on arterial stiffness. Am J Hypertens. 2004, 17, 299–303. [Google Scholar] [CrossRef]
- Tanriverdi, H.; Evrengul, H.; Kuru, O.; Tanriverdi, S.; Seleci, D.; Enli, Y.; et al. Cigarette smoking induced oxidative stress may impair endothelial function and coronary blood flow in angiographically normal coronary arteries. Circ J. 2006, 70, 593–599. [Google Scholar] [CrossRef]
- Perlstein, T.S.; Lee, R.T. Smoking, metalloproteinases, and vascular disease. Arterioscler Thromb Vasc Biol. 2006, 26, 250–256. [Google Scholar] [CrossRef]
- Lichodziejewska, B.; Kurnicka, K.; Grudzka, K.; Malysz, J.; Ciurzynski, M.; Liszewska-Pfejfer, D. Chronic and acute effects of smoking on left and right ventricular relaxation in young healthy smokers. Chest 2007, 131, 1142–1148. [Google Scholar] [CrossRef]
- Iribarren, C.; Tekawa, I.S.; Sidney, S.; Friedman, G.D. Effect of cigar smoking on the risk of cardiovascular disease, chronic obstructive pulmonary disease, and cancer in men. N Engl J Med. 1999, 340, 1773–1780. [Google Scholar] [CrossRef] [PubMed]
- Baker, F.; Ainsworth, S.R.; Dye, J.T.; Crammer, C.; Thun, M.J.; Hoffmann, D.; et al. Health risks associated with cigar smoking. JAMA 2000, 284, 735–740. [Google Scholar] [CrossRef] [PubMed]
- Shaper, A.G.; Wannamethee, S.G.; Walker, M. Pipe and cigar smoking and major cardiovascular events, cancer incidence and all-cause mortality in middleaged British men. Int J Epidemiol. 2003, 32, 802–808. [Google Scholar] [CrossRef]
- Fonarow, G.C.; Abraham, W.T.; Albert, N.M.; Stough, W.G.; Gheorghiade, M.; Greenberg, B.H.; et al. A smoker’s paradox in patients hospitalized for heart failure: findings from OPTIMIZE-HF. Eur Heart J. 2008, 29, 1983–1991. [Google Scholar] [CrossRef]
- Ashby, D.T.; Dangas, G.; Mehran, R.; Lansky, A.J.; Fahy, M.P.; Iakovou, I.; et al. Comparison of one-year outcomes after percutaneous coronary intervention among current smokers, ex-smokers, and nonsmokers. Am J Cardiol. 2002, 89, 221–224. [Google Scholar] [CrossRef]
- Suskin, N.; Sheth, T.; Negassa, A.; Yusuf, S. Relationship of current and past smoking to mortality and morbidity in patients with left ventricular dysfunction. J Am Coll Cardiol. 2001, 37, 1677–1682. [Google Scholar] [CrossRef] [PubMed]
- Goldenberg, I.; Moss, A.J.; McNitt, S.; Zareba, W.; Daubert, J.P.; Hall, W.J.; Multicenter Automatic Defibrillator Implantation Trial-II Investigators; et al. Cigarette smoking and the risk of supraventricular and ventricular tachyarrhythmias in high-risk cardiac patients with implantable cardioverter defibrillators. J Cardiovasc Electrophysiol. 2006, 17, 931–936. [Google Scholar] [CrossRef] [PubMed]
- Goldenberg, I.; Jonas, M.; Tenenbaum, A.; Boyko, V.; Matetzky, S.; Shotan, A.; Bezafibrate Infarction Prevention Study Group; et al. Current smoking, smoking cessation, and the risk of sudden cardiac death in patients with coronary artery disease. Arch Intern Med. 2003, 163, 2301–2305. [Google Scholar] [CrossRef]
- Grand, A.; Fichter, P.; Adeleine, P.; Huret, J.F.; Pernot, F.; Shibli, H. Effect of tobacco smoking on the incidence of recurrent myocardial infarction: a retrospective study of 208 cases [in French]. Ann Cardiol Angiol Paris. 1992, 41, 55–61. [Google Scholar]
- Gordon, T.; Kannel, W.B.; McGee, D.; Dawber, T.R. Death and coronary attacks in men after giving up cigarette smoking: a report from the Framingham Study. Lancet. 1974, 2, 1345–1348. [Google Scholar] [CrossRef]
- Dobson, A.J.; Alexander, H.M.; Heller, R.F.; Lloyd, D.M. How soon after quitting smoking does risk of heart attack decline? J Clin Epidemiol. 1991, 44, 1247–1253. [Google Scholar] [CrossRef]
- Negri, E.; La Vecchia, C.; D’Avanzo, B.; Nobili, A.; La Malfa, R.G. Acute myocardial infarction: association with time since stopping smoking in Italy: GISSIEFRIM Investigators. J Epidemiol Community Health. 1994, 48, 129–133. [Google Scholar] [CrossRef]
- Office on Smoking and Health. The health benefits of smoking cessation: a report of the surgeon general; US Office of the Surgeon General: Rockville, MD, USA, 1990. [Google Scholar]
- Lightwood, J.M.; Glantz, S.A. Short-term economic and health benefits of smoking cessation: myocardial infarction and stroke. Circulation 1997, 96, 1089–1096. [Google Scholar] [CrossRef]
- Gordon, T.; Kannel, W.B.; McGee, D.; Dawber, T.R. Death and coronary attacks in men after giving up cigarette smoking: a report from the Framingham Study. Lancet 1974, 2, 1345–1318. [Google Scholar] [CrossRef]
- Critchley, J.A.; Capewell, S. Mortality risk reduction associated with smoking cessation in patients with coronary heart disease: a systematic review. JAMA 2003, 290, 86–97. [Google Scholar] [CrossRef] [PubMed]
- Hashizume, K.; Yamaji, K.; Kusaka, Y.; Kawahara, K. Effects of abstinence from cigarette smoking on the cardiorespiratory capacity. Med Sci Sports Exerc. 2000, 32, 386–391. [Google Scholar] [CrossRef] [PubMed]
- Yotsukura, M.; Koide, Y.; Fujii, K.; Tomono, Y.; Katayama, A.; Ando, H.; et al. Heart rate variability during the first month of smoking cessation. Am Heart J. 1998, 135, 1004–1009. [Google Scholar] [CrossRef]
- Hatsukami, D.K.; Kotlyar, M.; Allen, S.; Jensen, J.; Li, S.; Le, C.; et al. Effects of cigarette reduction on cardiovascular risk factors and subjective measures. Chest 2005, 128, 2528–2537. [Google Scholar] [CrossRef]
- Kondo, T.; Hayashi, M.; Takeshita, K.; Numaguchi, Y.; Kobayashi, K.; Iino, S.; et al. Smoking cessation rapidly increases circulating progenitor cells in peripheral blood in chronic smokers. Arterioscler Thromb Vasc Biol. 2004, 24, 1442–1447. [Google Scholar] [CrossRef]
- Morita, H.; Ikeda, H.; Haramaki, N.; Eguchi, H.; Imaizumi, T. Only two-week smoking cessation improves platelet aggregability and intraplatelet redox imbalance of long-term smokers. J Am Coll Cardiol. 2005, 45, 589–594. [Google Scholar] [CrossRef]
- Haustein, K.O. What can we do in secondary prevention of cigarette smoking? Eur J Cardiovasc Prev Rehabil. 2003, 10, 476–485. [Google Scholar] [CrossRef] [PubMed]
- Simon, J.A.; Carmody, T.P.; Hudes, E.S.; Snyder, E.; Murray, J. Intensive smoking cessation counseling versus minimal counseling among hospitalized smokers treated with transdermal nicotine replacement: a randomized trial. Am J Med. 2003, 114, 555–562. [Google Scholar] [CrossRef] [PubMed]
- Mohiuddin, S.M.; Mooss, A.N.; Hunter, C.B.; Grollmes, T.L.; Cloutier, D.A.; Hilleman, D.E. Intensive smoking cessation intervention reduces mortality in high-risk smokers with cardiovascular disease. Chest 2007, 131, 446–452. [Google Scholar] [CrossRef]
- Van Spall, H.G.; Chong, A.; Tu, J.V. Inpatient smoking-cessation counseling and all-cause mortality in patients with acute myocardial infarction. Am Heart J. 2007, 154, 213–220. [Google Scholar] [CrossRef] [PubMed]
- Hubbard, R.; Lewis, S.; Smith, C.; Godfrey, C.; Smeeth, L.; Farrington, P.; et al. Use of nicotine replacement therapy and the risk of acute myocardial infarction, stroke, and death. J Tob Control. 2005, 14, 416–421. [Google Scholar] [CrossRef]
 |
 |
 |
 |
 |
© 2009 by the author. Attribution - Non-Commercial - NoDerivatives 4.0
Share and Cite
Saner, H. Rauchen und Kardiovaskuläre Erkrankungen. Cardiovasc. Med. 2009, 12, 305. https://doi.org/10.4414/cvm.2009.01456
Saner H. Rauchen und Kardiovaskuläre Erkrankungen. Cardiovascular Medicine. 2009; 12(11):305. https://doi.org/10.4414/cvm.2009.01456
Chicago/Turabian StyleSaner, Hugo. 2009. "Rauchen und Kardiovaskuläre Erkrankungen" Cardiovascular Medicine 12, no. 11: 305. https://doi.org/10.4414/cvm.2009.01456
APA StyleSaner, H. (2009). Rauchen und Kardiovaskuläre Erkrankungen. Cardiovascular Medicine, 12(11), 305. https://doi.org/10.4414/cvm.2009.01456




