Wertigkeit des EKG im Jahre 2007: Infarkt & Co. †
Summary
Zusammenfassung
Definition Myokardinfarkt
- –
- Ischämische Symptome (Angina pectoris usw.)
- –
- Entstehung von pathologischen Q-Zacken im EKG
- –
- EKG-Veränderungen, die auf eine myokardiale Ischämie hinweisen (ST-Hebung oder -Senkung)
- –
- Koronare Intervention
Die Prognose eines ST-HebungsInfarktes (STEMI) beeinflussende EKG-Faktoren
- Abschätzung des gefährdeten myokardialen Ischämieareales
- Unterscheidung zwischen viablem und nekrotischem Myokard im gefährdeten Ischämieareal
- Persistierend negative T-Wellenals Zeichen einer schlechteren Langzeit-Prognose

- ResiduellekumulativeST-StreckenAbweichungnachmechanischerReperfusionbeiSTEMI
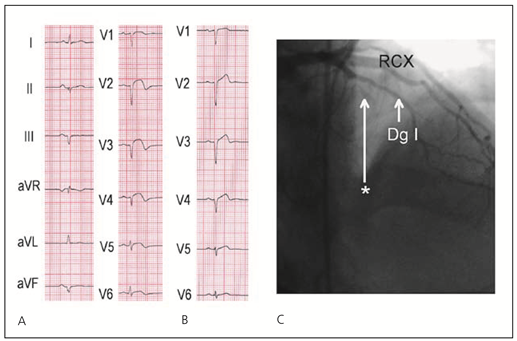
ST-Hebungs-Infarkt: Lokalisier-ung des Infarktgefässes
- –
- Hauptstammerkrankung und schwere Drei-Gefäss-Erkrankung
- –
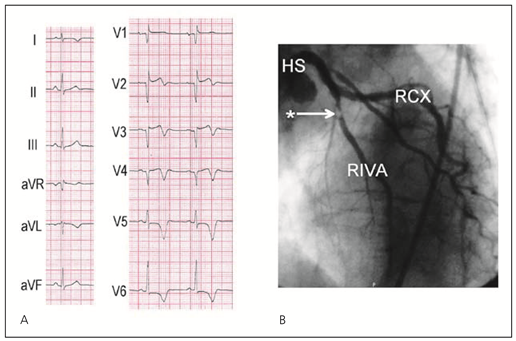
- RIVA-Verschluss proximal des ersten Septalastes
- –
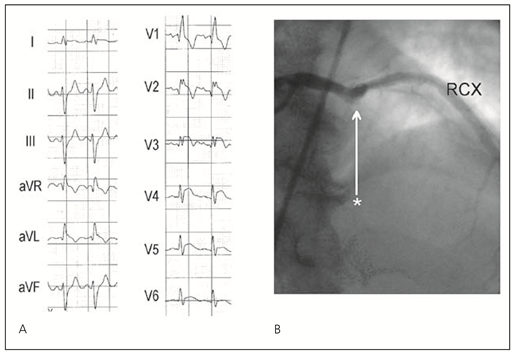
- Culprit-Gefäss bei inferiorem Infarkt
- –
- Rechtsventrikulärer Infarkt
- Hauptstammerkrankung und schwere Drei-Gefäss-Erkrankung
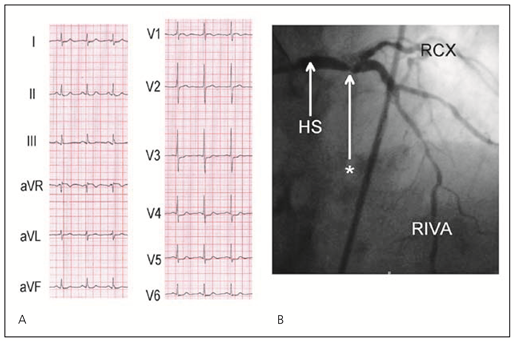

- RIVA-Verschluss proximal des ersten Septalastes
- –
- ST-Hebung in aVR und aVL
- –
- Rechtsschenkelblock (Abb. 4)
- –
- ST-Senkung in V5
- –
- ST-Hebung in V1 von über 2,5 mm
- Culprit-Gefäss bei inferiorem Infarkt
- Rechtsventrikulärer Infarkt
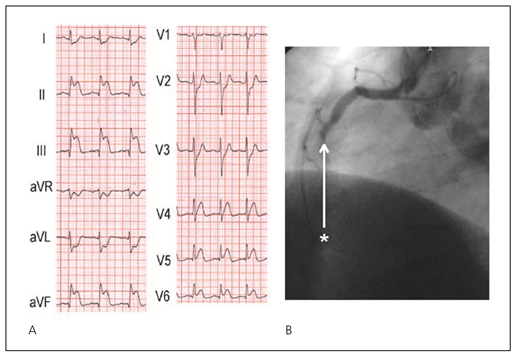
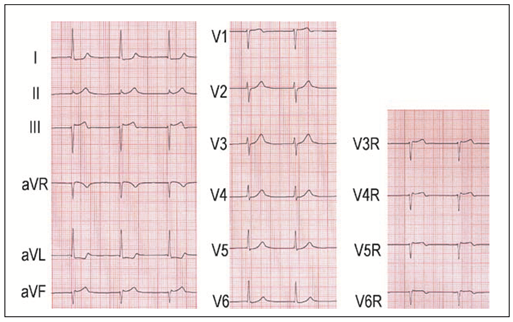
Nicht-ST-Hebungs-Infarkte
- QuantitativeBestimmungderST-Strecken-Veränderungen

- AnzahlderEKG-AbleitungenmitST-Strecken-Veränderungen
- IsolierteT-Wellen-Inversion
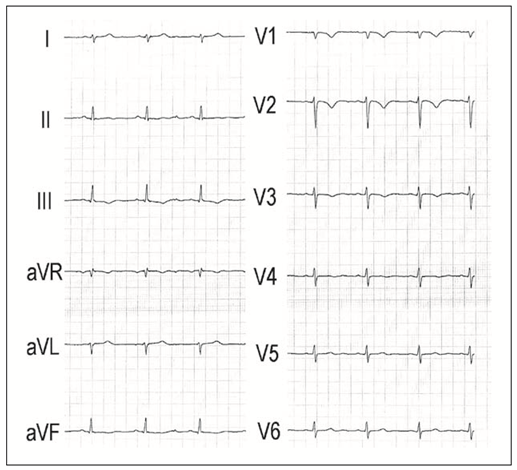
Differentialdiagnose
Conflicts of Interest
Literatur
- Myocardial infarction redefined—A consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardial infarction. Eur. Heart J. 2000, 21, 1502–1513. [CrossRef]
- Birnbaum, Y.; Chetrit, A.; Sclarovsky, S.; et al. Abnormal Q waves on the admission electrocardiogram of patients with first acute myocardial infarction: Prognostic implications. Clin. Cardiol. 1997, 20, 477–481. [Google Scholar] [CrossRef]
- Arnold, A.E.; Simoons, M.L. Expected infarct size without thrombolysis’, a concept that predicts immediate and longterm benefit from thrombolysis for evolving myocardial infarction. Eur. Heart J. 1997, 18, 1736–1748. [Google Scholar] [CrossRef]
- Aldrich, H.R.; Wagner, N.B.; Boswick, J.; et al. Use of initial STsegment deviation for prediction of final electrocardiographic size of acute myocardial infarcts. Am. J. Cardiol. 1988, 61, 749–753. [Google Scholar] [CrossRef] [PubMed]
- Willems, J.L.; Willems, R.J.; Willems, G.M.; et al. Significance of initial ST segment elevation and depression for the management of thrombolytic therapy in acute myocardial infarction. European Cooperative Study Group for Recombinant Tissue-Type Plasminogen Activator. Circulation 1990, 82, 1147–1158. [Google Scholar] [CrossRef] [PubMed]
- Clemmensen, P.; Grande, P.; Saunamaki, K.; et al. Effect of intravenous streptokinase on the relation between initial STpredicted size and final QRS-estimated size of acute myocardial infarcts. J. Am. Coll. Cardiol. 1990, 16, 1252–1257. [Google Scholar] [CrossRef]
- Bar, F.W.; Vermeer, F.; de Zwaan, C.; et al. Value of admission electrocardiogram in predicting outcome of thrombolytic therapy in acute myocardial infarction. A randomized trial conducted by The Netherlands Interuniversity Cardiology Institute. Am. J. Cardiol. 1987, 59, 6–13. [Google Scholar] [CrossRef] [PubMed]
- Christian, T.F.; Gibbons, R.J.; Clements, I.P.; et al. Estimates of myocardium at risk and collateral flow in acute myocardial infarction using electrocardiographic indexes with comparison to radionuclide and angiographic measures. J. Am. Coll. Cardiol. 1995, 26, 388–393. [Google Scholar] [CrossRef]
- Hathaway, W.R.; Peterson, E.D.; Wagner, G.S.; et al. Prognostic significance of the initial electrocardiogram in patients with acute myocardial infarction. GUSTO-I Investigators. Global Utilization of Streptokinase and t-PA for Occluded Coronary Arteries. JAMA 1998, 279, 387–391. [Google Scholar] [CrossRef]
- Sejersten, M.; Ripa, R.S.; Maynard, C.; et al. Usefulness of quantitative baseline ST-segment elevation for predicting outcomes after primary coronary angioplasty or fibrinolysis (results from the DANAMI-2 trial). Am. J. Cardiol. 2006, 97, 611–616. [Google Scholar] [CrossRef]
- Atar, S.; Barbagelata, A.; Birnbaum, Y. Electrocardiographic diagnosis of ST-elevation myocardial infarction. Cardiol. Clin. 2006, 24, 343–365. [Google Scholar] [CrossRef]
- Matetzky, S.; Barabash, G.I.; Shahar, A.; et al. Early T wave inversion after thrombolytic therapy predicts better coronary perfusion: Clinical and angiographic study. J. Am. Coll. Cardiol. 1994, 24, 378–383. [Google Scholar] [CrossRef][Green Version]
- Herz, I.; Birnbaum, Y.; Zlotikamien, B.; et al. The prognostic implications of negative T waves in the leads with ST segment elevation on admission in acute myocardial infarction. Cardiology. 1999, 92, 121–127. [Google Scholar] [CrossRef]
- Lancellotti, P.; Gerard, P.L.; Kulbertus, H.E.; et al. Persistent negative T waves in the infarct-related leads as an independent predictor of poor long-term prognosis after acute myocardial infarction. Am. J. Cardiol. 2002, 90, 833–837. [Google Scholar] [CrossRef]
- Maeda, S.; Imai, T.; Kuboki, K.; et al. Pathologic implications of restored positive T waves and persistent negative T waves after Q wave myocardial infarction. J. Am. Coll. Cardiol. 1996, 28, 1514–1518. [Google Scholar] [CrossRef] [PubMed]
- De Luca, G.; Maas, A.C.; van’t Hof, A.W.; et al. Impact of ST-segment depression resolution on mortality after successful mechanical reperfusion in patients with ST-segment elevation acute myocardial infarction. Am. J. Cardiol. 2005, 95, 234–236. [Google Scholar] [CrossRef] [PubMed]
- Yamaji, H.; Iwasaki, K.; Kusachi, S.; et al. Prediction of acute left main coronary artery obstruction by 12-lead electrocardiography. ST segment elevation in lead aVR with less ST segment elevation in lead V(1). J Am Coll Cardiol. 2001, 38, 1348–1354. [Google Scholar] [CrossRef]
- Engelen, D.J.; Gorgels, A.P.; Cheriex, E.C.; et al. Value of the electrocardiogram in localizing the occlusion site in the left anterior descending coronary artery in acute anterior myocardial infarction. J. Am. Coll. Cardiol. 1999, 34, 389–395. [Google Scholar] [CrossRef] [PubMed]
- Mehta, S.R.; Eikelboom, J.W.; Natarajan, M.K.; et al. Impact of right ventricular involvement on mortality and morbidity in patients with inferior myocardial infarction. J. Am. Coll. Cardiol. 2001, 37, 37–43. [Google Scholar] [CrossRef]
- Pfisterer, M. Right ventricular involvement in myocardial infarction and cardiogenic shock. Lancet 2003, 362, 392–394. [Google Scholar] [CrossRef]
- Holmvang, L.; Clemmensen, P.; Lindahl, B.; et al. Quantitative analysis of the admission electrocardiogram identifies patients with unstable coronary artery disease who benefit the most from early invasive treatment. J. Am. Coll. Cardiol. 2003, 41, 905–915. [Google Scholar] [CrossRef]
- Fox, K.A.; Dabbous, O.H.; Goldberg, R.J.; et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: Prospective multinational observational study (GRACE). BMJ 2006, 333, 1091. [Google Scholar] [CrossRef]
- Westerhout, C.M.; Fu, Y.; Lauer, M.S.; et al. Shortand long-term risk stratification in acute coronary syndromes: The added value of quantitative ST-segment depression and multiple biomarkers. J. Am. Coll. Cardiol. 2006, 48, 939–947. [Google Scholar] [CrossRef]
- Collinson, J.; Bakhai, A.; Taneja, A.; et al. Admission ECG predicts long-term outcome in acute coronary syndromes without ST elevation. Qjm 2006, 99, 601–607. [Google Scholar] [CrossRef] [PubMed]
- Mueller, C.; Neumann, F.J.; Perach, W.; et al. Prognostic value of the admission electrocardiogram in patients with unstable angina/non-ST-segment elevation myocardial infarction treated with very early revascularization. Am. J. Med. 2004, 117, 145–150. [Google Scholar] [CrossRef] [PubMed]
- Assali, A.R.; Herz, I.; Vaturi, M.; et al. Electrocardiographic criteria for predicting the culprit artery in inferior wall acute myocardial infarction. Am. J. Cardiol. 1999, 84, 87–89. [Google Scholar] [CrossRef]
- Herz, I.; Assali, A.R.; Adler, Y.; et al. New electrocardiographic criteria for predicting either the right or left circumflex artery as the culprit coronary artery in inferior wall acute myocardial infarction. Am. J. Cardiol. 1997, 80, 1343–1345. [Google Scholar] [CrossRef]
- Zimetbaum, P.J.; Krishnan, S.; Gold, A.; et al. Usefulness of STsegment elevation in lead III exceeding that of lead II for identifying the location of the totally occluded coronary artery in inferior wall myocardial infarction. Am. J. Cardiol. 1998, 81, 918–919. [Google Scholar] [CrossRef] [PubMed]
© 2008 by the authors. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Kobza, R.; Jamshidi, P.; Erne, P. Wertigkeit des EKG im Jahre 2007: Infarkt & Co. Cardiovasc. Med. 2008, 11, 83. https://doi.org/10.4414/cvm.2008.01314
Kobza R, Jamshidi P, Erne P. Wertigkeit des EKG im Jahre 2007: Infarkt & Co. Cardiovascular Medicine. 2008; 11(3):83. https://doi.org/10.4414/cvm.2008.01314
Chicago/Turabian StyleKobza, Richard, Peiman Jamshidi, and Paul Erne. 2008. "Wertigkeit des EKG im Jahre 2007: Infarkt & Co." Cardiovascular Medicine 11, no. 3: 83. https://doi.org/10.4414/cvm.2008.01314
APA StyleKobza, R., Jamshidi, P., & Erne, P. (2008). Wertigkeit des EKG im Jahre 2007: Infarkt & Co. Cardiovascular Medicine, 11(3), 83. https://doi.org/10.4414/cvm.2008.01314



