Nutzen und Risiken von Medikamentös Beschichteten Stents †
Einleitung

Nutzen von medikamentös beschichteten Koronarstents
Risiken von medikamentös beschichteten Koronarstents
Sicherheit von medikamentös beschichteten Koronarstents
Empfehlungen zur Vermeidung von Komplikationen beim Einsatz von medikamentös beschichteten Stents der ersten Generation
Synthese der Daten
- (1.)
- Im Vergleich zu BMS führen DES zu einer wirkungsvollen Reduktion des Bedarfs an erneuten Revaskularisationseingriffen.
- (2.)
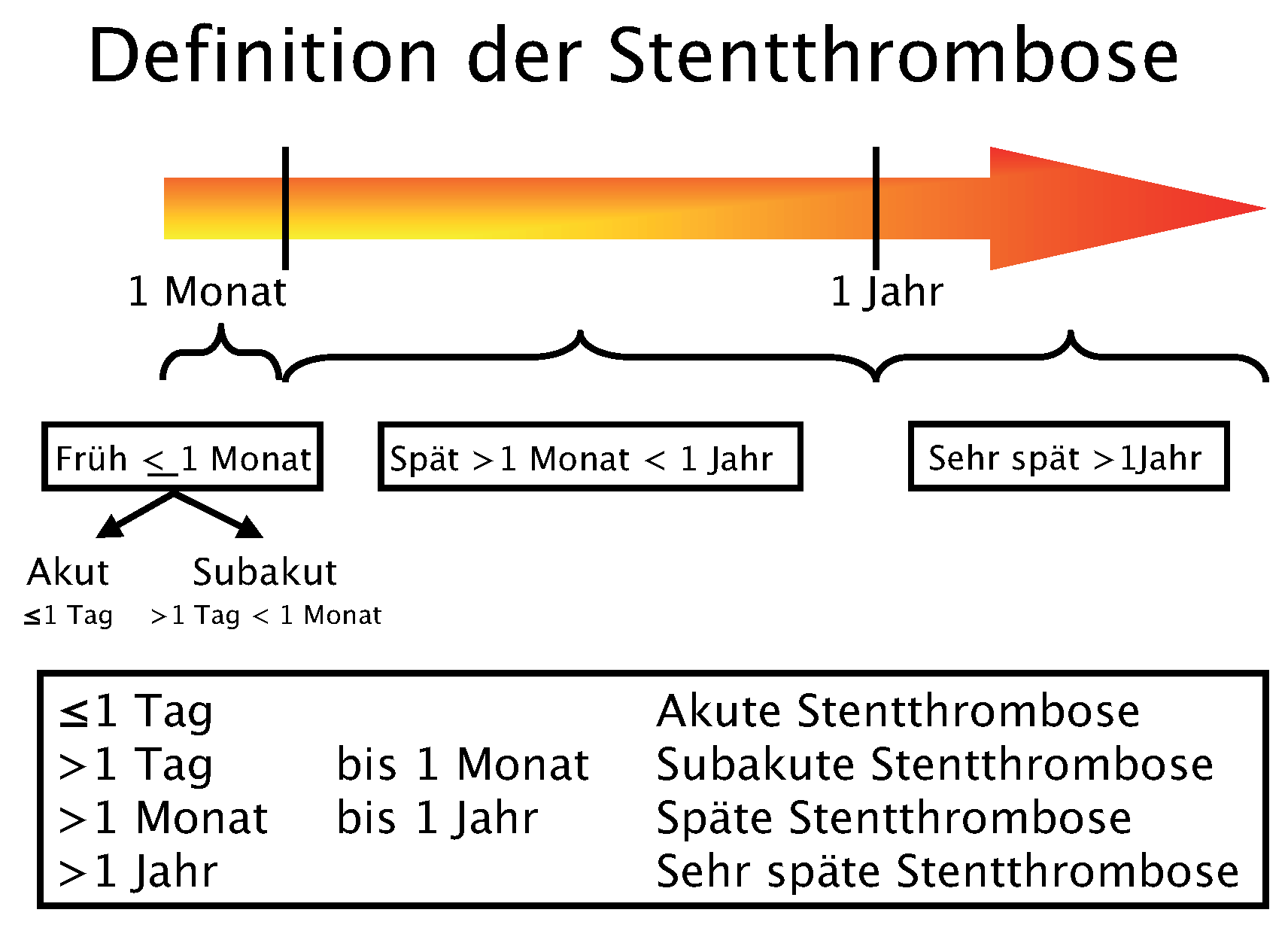
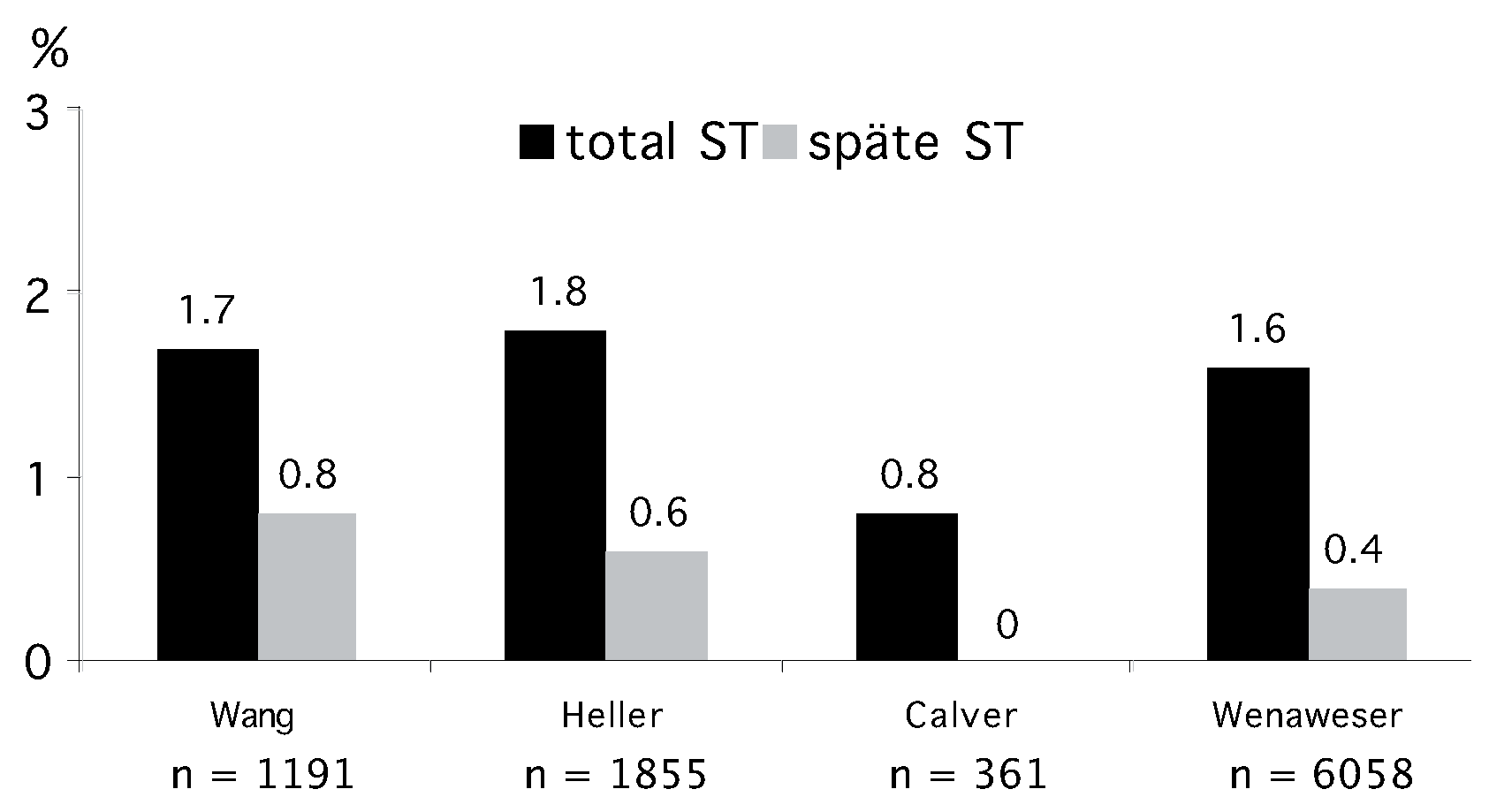
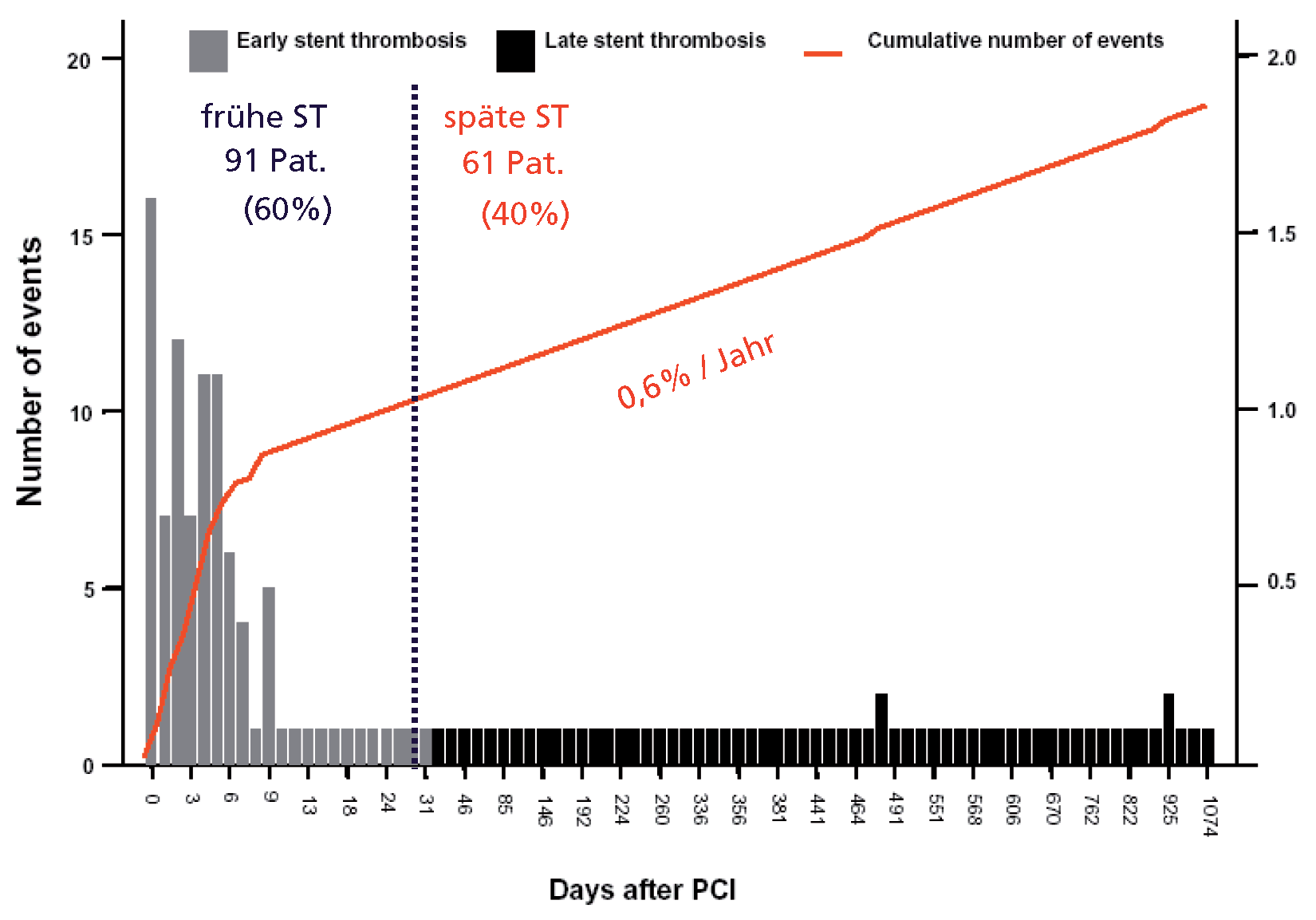
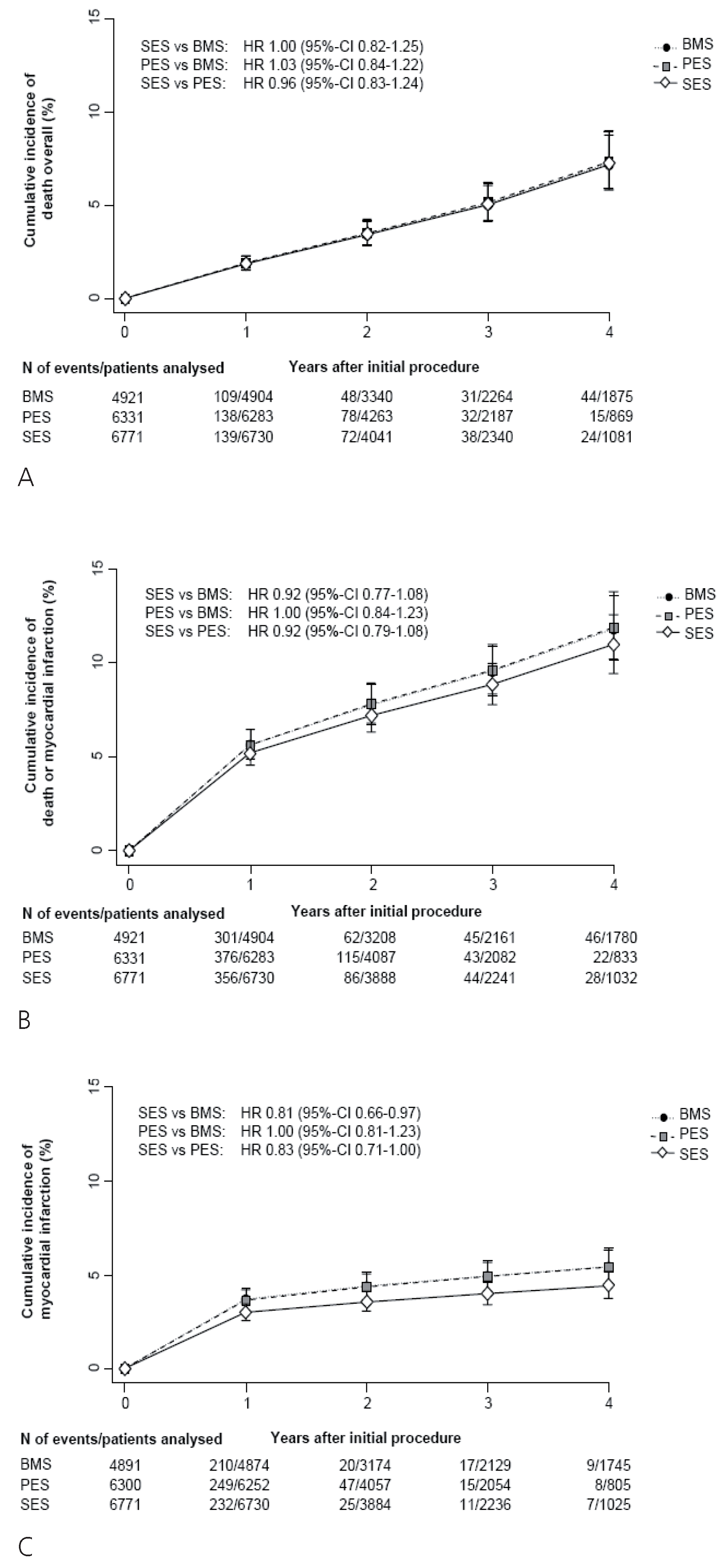
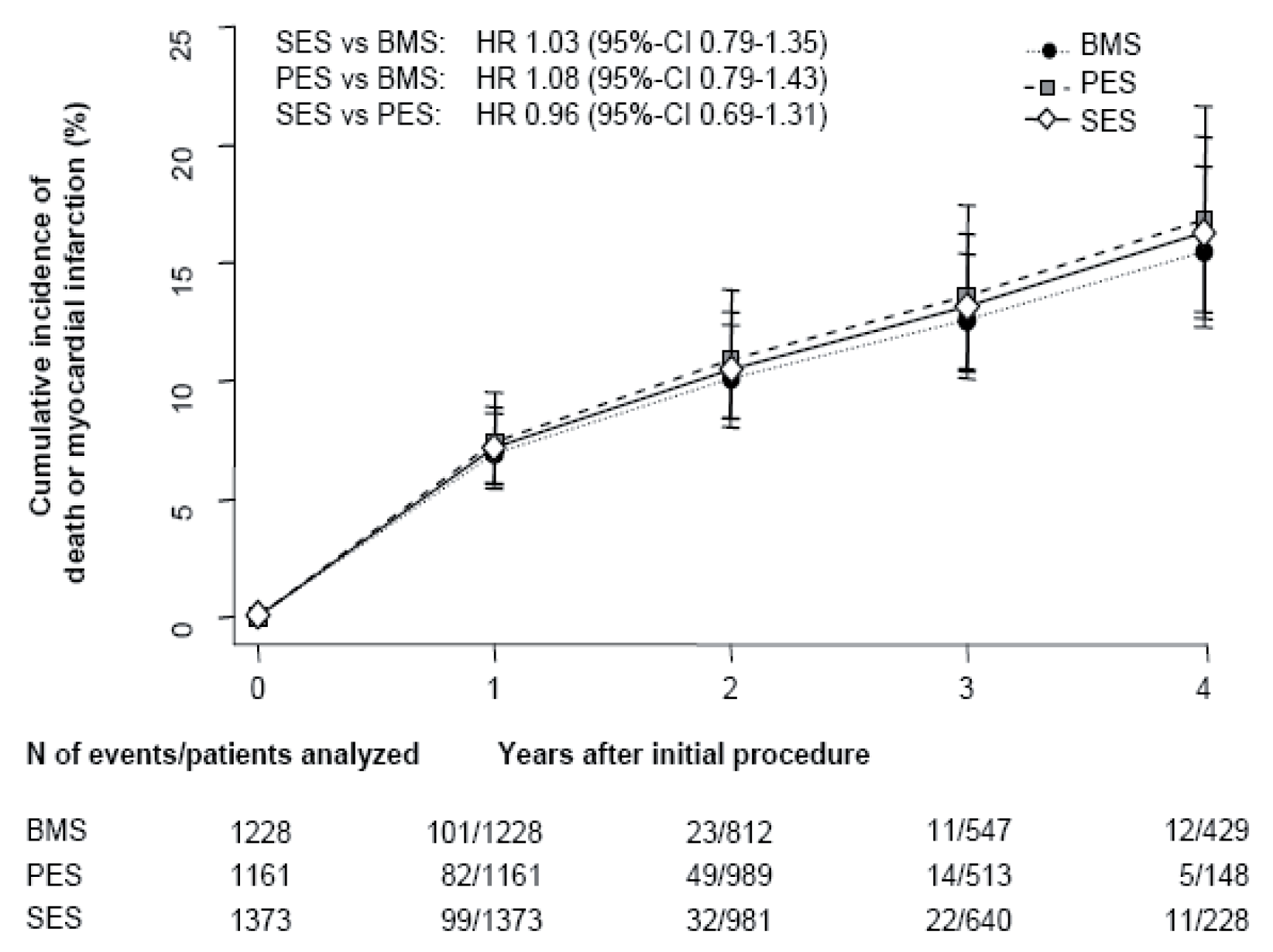
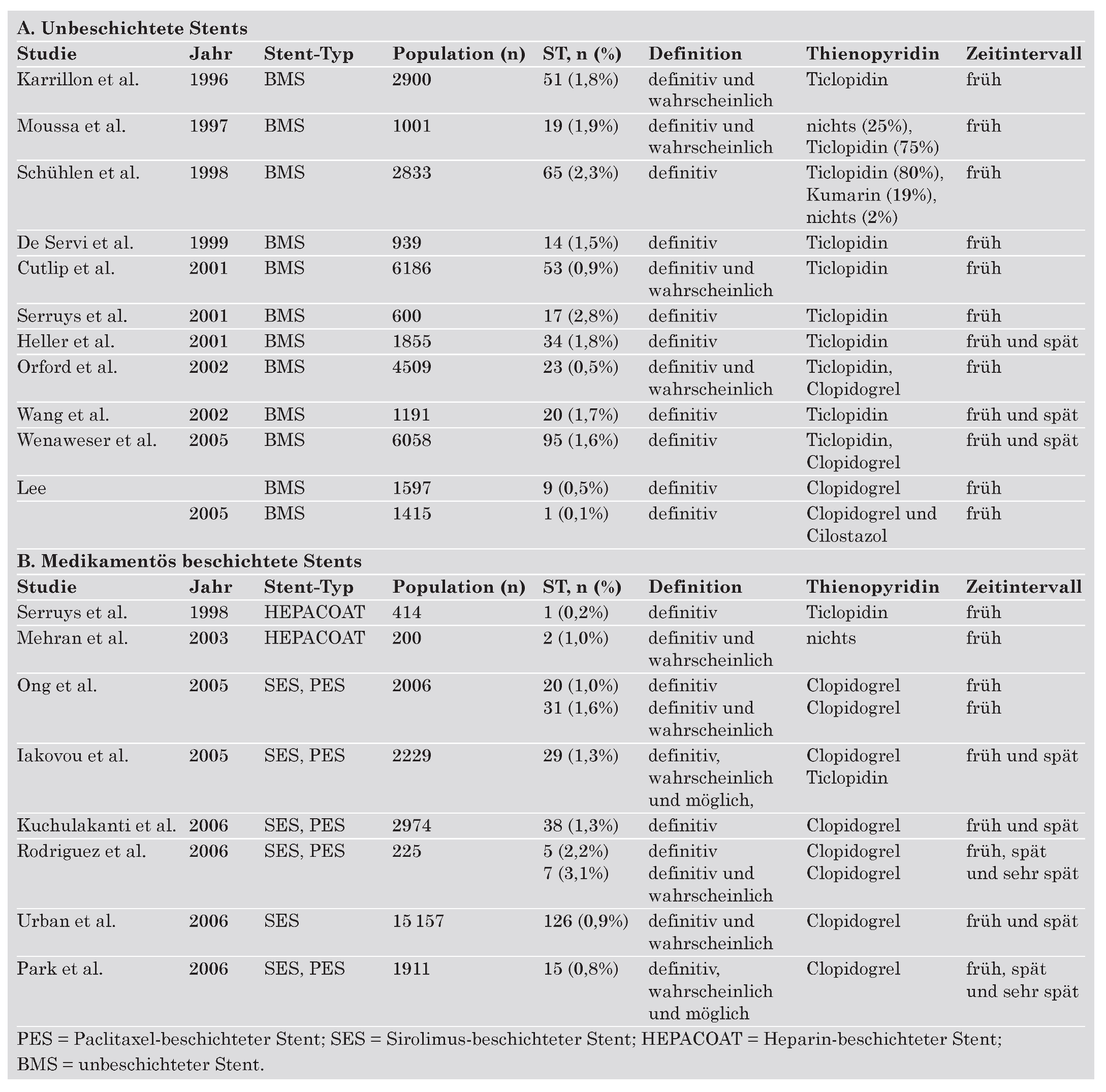
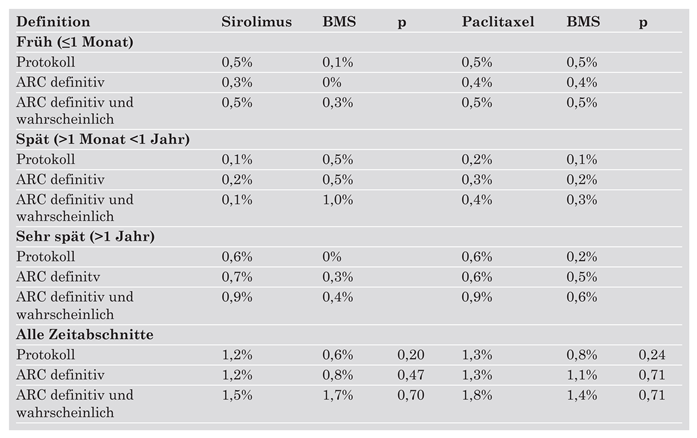
- Es finden sich keine signifikanten Unterschiede im Risiko von frühen und späten Stent-Thrombosen. Die Inzidenz von sehr späten Stentthrombosen (>1 Jahr) erscheint mit DES der ersten Generation etwas höher verglichen mit BMS. Dieses leicht erhöhte Risiko ist jedoch nicht mit einer höheren Todesoder Myokardinfarktrate vergesellschaftet. Mögliche Erklärungen hierfür sind, dass die kumulative Inzidenz von Stent-Thrombosen nicht signifikant unterschiedlich ist, dass die Patientenpopulation vergleichender Studien zu klein ist, um einen eventuellen Unterschied nachzuweisen, oder dass sekundäre Stent-Thrombosen nach interkurrenter Revaskularisation etwas häufiger mit BMS auftreten.
- (3.)
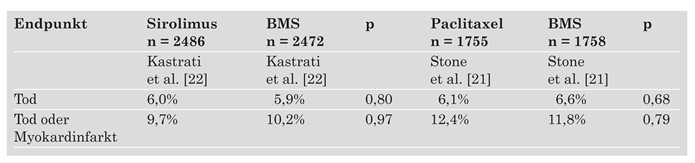
- Bis zu einem Verlauf von 4 Jahren finden sich keine Hinweise für Unterschiede in der Inzidenz von Tod und Myokardinfarkt zwischen DES und BMS.
- (4.)
- Das leicht erhöhte Risiko von sehr späten Stent-Thrombosen wird durch den überwiegenden Nutzen in der Reduktion erneuter Revaskularisationseingriffe und der Vermeidung von damit vergesellschafteten Risiken kompensiert.
- (5.)
- Weitere Untersuchungen des Langzeitverlaufs sowie des Einsatzes bei komplexen Patienten und Läsionen sind notwendig, um das Sicherheitsprofil von DES der ersten und weiterer Generation im klinischen Alltag nachhaltig zu beurteilen.
- (6.)
- Die Ausführungen dieser Arbeit beziehen sich ausschliesslich auf Daten mit DES der ersten Generation und können nicht auf neuere Stent-Generationen übertragen werden.
References
- Sigwart, U.; Puel, J.; Mirkovitch, V.; Joffre, F.; Kappenberger, L. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med. 1987, 316, 701–706. [Google Scholar] [CrossRef]
- Windecker, S.; Meier, B. Intervention in coronary artery disease. Heart. 2000, 83, 481–490. [Google Scholar] [CrossRef]
- Detre, K.; Holubkov, R.; Kelsey, S.; Bourassa, M.; Williams, D.; Holmes, D., Jr.; et al. One-year follow-up results of the 1985–1986 National Heart, Lung, and Blood Institute’s Percutaneous Transluminal Coronary Angioplasty Registry. Circulation. 1989, 80, 421–448. [Google Scholar] [CrossRef] [PubMed]
- Roubin, G.S.; Cannon, A.D.; Agrawal, S.K.; Macander, P.J.; Dean, L.S.; Baxley, W.A.; et al. Intracoronary stenting for acute and threatened closure complicating percutaneous transluminal coronary angioplasty. Circulation. 1992, 85, 916–927. [Google Scholar] [CrossRef] [PubMed]
- Schomig, A.; Kastrati, A.; Mudra, H.; Blasini, R.; Schuhlen, H.; Klauss, V.; et al. Four-year experience with Palmaz-Schatz stenting in coronary angioplasty complicated by dissection with threatened or present vessel closure. Circulation. 1994, 90, 2716–2724. [Google Scholar] [CrossRef] [PubMed]
- Brophy, J.M.; Belisle, P.; Joseph, L. Evidence for use of coronary stents. A hierarchical bayesian meta-analysis. Ann Intern Med. 2003, 138, 777–786. [Google Scholar] [CrossRef]
- Morice, M.C.; Serruys, P.W.; Sousa, J.E.; Fajadet, J.; Ban Hayashi, E.; Perin, M.; et al. A randomized comparison of a sirolimuseluting stent with a standard stent for coronary revascularization. N Engl J Med. 2002, 346, 1773–1780. [Google Scholar] [CrossRef]
- Moses, J.W.; Leon, M.B.; Popma, J.J.; Fitzgerald, P.J.; Holmes, D.R.; O’Shaughnessy, C.; et al. Sirolimus-eluting stents versus standard stents in patients with stenosis in a native coronary artery. N Engl J Med. 2003, 349, 1315–1323. [Google Scholar] [CrossRef]
- Stone, G.W.; Ellis, S.G.; Cox, D.A.; Hermiller, J.; O’Shaughnessy, C.; Mann, J.T.; et al. A polymer-based, paclitaxel-eluting stent in patients with coronary artery disease. N Engl J Med. 2004, 350, 221–231. [Google Scholar] [CrossRef]
- Babapulle, M.N.; Joseph, L.; Belisle, P.; Brophy, J.M.; Eisenberg, M.J. A hierarchical Bayesian meta-analysis of randomised clinical trials of drug-eluting stents. Lancet. 2004, 364, 583–591. [Google Scholar] [CrossRef]
- Stone, G.W.; Ellis, S.G.; Cannon, L.; Mann, J.T.; Greenberg, J.D.; Spriggs, D.; et al. Comparison of a polymer-based paclitaxeleluting stent with a bare metal stent in patients with complex coronary artery disease: a randomized controlled trial. JAMA. 2005, 294, 1215–1223. [Google Scholar] [CrossRef]
- Kaiser, C.; Brunner-La Rocca, H.P.; Buser, P.T.; Bonetti, P.O.; Osswald, S.; Linka, A.; et al. Incremental cost-effectiveness of drug-eluting stents compared with a third-generation baremetal stent in a real-world setting: randomised Basel Stent Kosten Effektivitats Trial (BASKET). Lancet. 2005, 366, 921–929. [Google Scholar] [CrossRef]
- Windecker, S.; Remondino, A.; Eberli, F.R.; Juni, P.; Raber, L.; Wenaweser, P.; et al. Sirolimus-eluting and paclitaxel-eluting stents for coronary revascularization. N Engl J Med. 2005, 353, 653–662. [Google Scholar] [CrossRef]
- Morice, M.C.; Colombo, A.; Meier, B.; Serruys, P.; Tamburino, C.; Guagliumi, G.; et al. Sirolimus- vs paclitaxel-eluting stents in de novo coronary artery lesions: the REALITY trial: a randomized controlled trial. JAMA. 2006, 295, 895–904. [Google Scholar] [CrossRef]
- Serruys, P.W.; Kutryk, M.J.; Ong, A.T. Coronary-artery stents. N Engl J Med. 2006, 354, 483–495. [Google Scholar] [CrossRef] [PubMed]
- Togni, M.; Windecker, S.; Meier, B. Treatment of restenosis. Curr Interv Cardiol Rep. 2001, 3, 306–310. [Google Scholar]
- McFadden, E.P.; Stabile, E.; Regar, E.; Cheneau, E.; Ong, A.T.; Kinnaird, T.; et al. Late thrombosis in drug-eluting coronary stents after discontinuation of antiplatelet therapy. Lancet. 2004, 364, 1519–1521. [Google Scholar] [CrossRef]
- Bavry, A.A.; Kumbhani, D.J.; Helton, T.J.; Borek, P.P.; Mood, G.R.; Bhatt, D.L. Late thrombosis of drug-eluting stents: a meta-analysis of randomized clinical trials. Am J Med. 2006, 119, 1056–1061. [Google Scholar] [CrossRef]
- Daemen, J.; Wenaweser, P.; Tsuchida, K.; Abrecht, L.; Vaina, S.; Morger, C.; et al. Early and late coronary stent thrombosis of sirolimus-eluting and paclitaxel-eluting stents in routine clinical practice: data from a large two-institutional cohort study. Lancet. 2007, 369, 667–678. [Google Scholar] [CrossRef] [PubMed]
- Poon, M.; Badimon, J.J.; Fuster, V. Overcoming restenosis with sirolimus: from alphabet soup to clinical reality. Lancet. 2002, 359, 619–622. [Google Scholar] [CrossRef]
- Stone, G.W.; Moses, J.W.; Ellis, S.G.; Schofer, J.; Dawkins, K.D.; Morice, M.C.; et al. Safety and efficacy of sirolimus- and paclitaxel-eluting coronary stents. N Engl J Med. 2007, 356, 998–1008. [Google Scholar] [CrossRef]
- Kastrati, A.; Mehilli, J.; Pache, J.; Kaiser, C.; Valgimigli, M.; Kelbaek, H.; et al. Analysis of 14 trials comparing sirolimus-eluting stents with bare-metal stents. N Engl J Med. 2007, 356, 1030–1039. [Google Scholar] [CrossRef]
- Stettler, C.; Wandel, S.; Allemann, S.; Kastrati, A.; Morice, M.C.; Schömig, A.; et al. Outcomes associated with drug-eluting and bare-metal stents: a collaborative network meta-analysis. Lancet. 2007, 370(9591), 937–948. [Google Scholar] [CrossRef] [PubMed]
- Clark, M.A.; Bakhai, A.; Lacey, M.J.; Pelletier, E.M.; Cohen, D.J. Clinical and economic outcomes of percutaneous coronary interventions in the elderly: an analysis of medicare claims data. Circulation. 2004, 110, 259–264, Epub 2004 Jun 28. [Google Scholar] [CrossRef]
- Weaver, W.D.; Reisman, M.A.; Griffin, J.J.; Buller, C.E.; Leimgruber, P.P.; Henry, T.; et al. Optimum percutaneous transluminal coronary angioplasty compared with routine stent strategy trial (OPUS-1): a randomised trial. Lancet. 2000, 355, 2199–2203. [Google Scholar] [CrossRef] [PubMed]
- Walters, D.L.; Harding, S.A.; Walsh, C.R.; Wong, P.; Pomerantsev, E.; Jang, I.K. Acute coronary syndrome is a common clinical presentation of in-stent restenosis. Am J Cardiol. 2002, 89, 491–494. [Google Scholar] [CrossRef]
- Chen, M.S.; John, J.M.; Chew, D.P.; Lee, D.S.; Ellis, S.G.; Bhatt, D.L. Bare metal stent restenosis is not a benign clinical entity. Am Heart J. 2006, 151, 1260–1264. [Google Scholar] [CrossRef]
- Stone, G.W.; Ellis, S.G.; Colombo, A.; Dawkins, K.D.; Grube, E.; Cutlip, D.E.; et al. Offsetting impact of thrombosis and restenosis on the occurrence of death and myocardial infarction after paclitaxel-eluting and bare metal stent implantation. Circulation. 2007, 115, 2842–2847. [Google Scholar] [CrossRef] [PubMed]
- Van Belle, E.; Ketelers, R.; Bauters, C.; Perie, M.; Abolmaali, K.; Richard, F.; et al. Patency of percutaneous transluminal coronary angioplasty sites at 6-month angiographic follow-up: A key determinant of survival in diabetics after coronary balloon angioplasty. Circulation. 2001, 103, 1218–1224. [Google Scholar] [CrossRef]
- Schuhlen, H.; Kastrati, A.; Mehilli, J.; Hausleiter, J.; Pache, J.; Dirschinger, J.; et al. Restenosis detected by routine angiographic follow-up and late mortality after coronary stent placement. Am Heart J. 2004, 147, 317–322. [Google Scholar]
- Maisel, W.H. Unanswered questions—drug-eluting stents and the risk of late thrombosis. N Engl J Med. 2007, 356, 981–984. [Google Scholar] [CrossRef]
- Farb, A.; Boam, A.B. Stent thrombosis redux – the FDA perspective. N Engl J Med. 2007, 356, 984–987, Epub 2007 Feb 12. [Google Scholar] [CrossRef]
- Windecker, S.; Meier, B. Late coronary stent thrombosis. Circulation. 2007, 116, 1952–1965. [Google Scholar] [CrossRef]
- Foley, J.B.; Brown, R.I.; Penn, I.M. Thrombosis and restenosis after stenting in failed angioplasty: comparison with elective stenting. Am Heart J. 1994, 128, 12–20. [Google Scholar] [CrossRef]
- Karrillon, G.J.; Morice, M.C.; Benveniste, E.; Bunouf, P.; Aubry, P.; Cattan, S.; et al. Intracoronary stent implantation without ultrasound guidance and with replacement of conventional anticoagulation by antiplatelet therapy. 30-day clinical outcome of the French Multicenter Registry. Circulation. 1996, 94, 1519–1527. [Google Scholar] [CrossRef]
- Moussa, I.; Di Mario, C.; Reimers, B.; Akiyama, T.; Tobis, J.; Colombo, A. Subacute stent thrombosis in the era of intravascular ultrasound-guided coronary stenting without anticoagulation: frequency, predictors and clinical outcome. J Am Coll Cardiol. 1997, 29, 6–12. [Google Scholar] [CrossRef]
- Schuhlen, H.; Kastrati, A.; Dirschinger, J.; Hausleiter, J.; Elezi, S.; Wehinger, A.; et al. Intracoronary stenting and risk for major adverse cardiac events during the first month. Circulation. 1998, 98, 104–111. [Google Scholar] [CrossRef] [PubMed]
- De Servi, S.; Repetto, S.; Klugmann, S.; Bossi, I.; Colombo, A.; Piva, R.; et al. Stent thrombosis: incidence and related factors in the R.I.S.E. Registry (Registro Impianto Stent Endocoronarico). Catheter Cardiovasc Interv. 1999, 46, 13–18. [Google Scholar] [CrossRef]
- Cutlip, D.E.; Baim, D.S.; Ho, K.K.; Popma, J.J.; Lansky, A.J.; Cohen, D.J.; et al. Stent thrombosis in the modern era: a pooled analysis of multicenter coronary stent clinical trials. Circulation. 2001, 103, 1967–1971. [Google Scholar] [CrossRef] [PubMed]
- Serruys, P.W.; Unger, F.; Sousa, J.E.; Jatene, A.; Bonnier, H.J.; Schonberger, J.P.; et al. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med. 2001, 344, 1117–1124. [Google Scholar] [CrossRef]
- Heller, L.I.; Shemwell, K.C.; Hug, K. Late stent thrombosis in the absence of prior intracoronary brachytherapy. Catheter Cardiovasc Interv. 2001, 53, 23–28. [Google Scholar] [CrossRef]
- Orford, J.L.; Lennon, R.; Melby, S.; Fasseas, P.; Bell, M.R.; Rihal, C.S.; et al. Frequency and correlates of coronary stent thrombosis in the modern era: analysis of a single center registry. J Am Coll Cardiol. 2002, 40, 1567–1572. [Google Scholar] [CrossRef]
- Wang, F.; Stouffer, G.A.; Waxman, S.; Uretsky, B.F. Late coronary stent thrombosis: early vs. late stent thrombosis in the stent era. Catheter Cardiovasc Interv. 2002, 55, 142–147. [Google Scholar] [CrossRef]
- Wenaweser, P.; Rey, C.; Eberli, F.R.; Togni, M.; Tuller, D.; Locher, S.; et al. Stent thrombosis following bare-metal stent implantation: success of emergency percutaneous coronary intervention and predictors of adverse outcome. Eur Heart J. 2005, 26, 1180–1187. [Google Scholar] [CrossRef] [PubMed]
- Lee, S.W.; Park, S.W.; Hong, M.K.; Kim, Y.H.; Lee, B.K.; Song, J.M.; et al. Triple versus dual antiplatelet therapy after coronary stenting: impact on stent thrombosis. J Am Coll Cardiol. 2005, 46, 1833–1837. [Google Scholar] [CrossRef] [PubMed]
- Serruys, P.W.; van Hout, B.; Bonnier, H.; Legrand, V.; Garcia, E.; Macaya, C.; et al. Randomised comparison of implantation of heparin-coated stents with balloon angioplasty in selected patients with coronary artery disease (Benestent II). Lancet. 1998, 352, 673–681. [Google Scholar] [CrossRef]
- Mehran, R.; Aymong, E.D.; Ashby, D.T.; Fischell, T.; Whitworth, H.; Jr. Siegel, R.; et al. Safety of an aspirin-alone regimen after intracoronary stenting with a heparin-coated stent: final results of the HOPE (HEPACOAT and an Antithrombotic Regimen of Aspirin Alone) study. Circulation. 2003, 108, 1078–1083. [Google Scholar] [CrossRef] [PubMed]
- Ong, A.T.; Hoye, A.; Aoki, J.; van Mieghem, C.A.; Rodriguez Granillo, G.A.; Sonnenschein, K.; et al. Thirty-day incidence and six-month clinical outcome of thrombotic stent occlusion after bare-metal, sirolimus, or paclitaxel stent implantation. J Am Coll Cardiol. 2005, 45, 947–953. [Google Scholar] [CrossRef]
- Iakovou, I.; Schmidt, T.; Bonizzoni, E.; Ge, L.; Sangiorgi, G.M.; Stankovic, G.; et al. Incidence, predictors, and outcome of thrombosis after successful implantation of drug-eluting stents. JAMA. 2005, 293, 2126–2130. [Google Scholar] [CrossRef]
- Kuchulakanti, P.K.; Chu, W.W.; Torguson, R.; Ohlmann, P.; Rha, S.W.; Clavijo, L.C.; et al. Correlates and long-term outcomes of angiographically proven stent thrombosis with sirolimus- and paclitaxel-eluting stents. Circulation. 2006, 113, 1108–1113. [Google Scholar] [CrossRef]
- Rodriguez, A.E.; Mieres, J.; Fernandez-Pereira, C.; Vigo, C.F.; Rodriguez-Alemparte, M.; Berrocal, D.; et al. Coronary stent thrombosis in the current drug-eluting stent era: insights from the ERACI III trial. J Am Coll Cardiol. 2006, 47, 205–207. [Google Scholar] [CrossRef]
- Urban, P.; Gershlick, A.H.; Guagliumi, G.; Guyon, P.; Lotan, C.; Schofer, J.; et al. Safety of coronary sirolimus-eluting stents in daily clinical practice: one-year follow-up of the e-Cypher registry. Circulation. 2006, 113, 1434–1441. [Google Scholar] [CrossRef] [PubMed]
- Park, D.W.; Park, S.W.; Park, K.H.; Lee, B.K.; Kim, Y.H.; Lee, C.W.; et al. Frequency of and risk factors for stent thrombosis after drug-eluting stent implantation during long-term follow-up. Am J Cardiol. 2006, 98, 352–356. [Google Scholar] [CrossRef] [PubMed]
- Cutlip, D.E.; Windecker, S.; Mehran, R.; Boam, A.; Cohen, D.J.; Van Es, G.A.; et al. Clinical endpoints in coronary stent trials: a case for standardized definitions. Circulation. 2007, 115, 2344–2351. [Google Scholar] [CrossRef]
- Bavry, A.A.; Kumbhani, D.J.; Helton, T.J.; Bhatt, D.L. Risk of thrombosis with the use of sirolimus-eluting stents for percutaneous coronary intervention (from registry and clinical trial data). Am J Cardiol. 2005, 95, 1469–1472. [Google Scholar] [CrossRef]
- Bavry, A.A.; Kumbhani, D.J.; Helton, T.J.; Bhatt, D.L. What is the risk of stent thrombosis associated with the use of paclitaxel-eluting stents for percutaneous coronary intervention? a meta-analysis. J Am Coll Cardiol. 2005, 45, 941–946. [Google Scholar] [CrossRef][Green Version]
- Pfisterer, M.; Brunner-La Rocca, H.P.; Buser, P.T.; Rickenbacher, P.; Hunziker, P.; Mueller, C.; et al. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents: an observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol. 2006, 48, 2584–2591. [Google Scholar] [CrossRef]
- Mauri, L.; Hsieh, W.H.; Massaro, J.M.; Ho, K.K.; D’Agostino, R.; Cutlip, D.E. Stent thrombosis in randomized clinical trials of drug-eluting stents. N Engl J Med. 2007, 356, 1020–1029. [Google Scholar] [CrossRef]
- Lagerqvist, B.; James, S.K.; Stenestrand, U.; Lindback, J.; Nilsson, T.; Wallentin, L. Long-term outcomes with drug-eluting stents versus bare-metal stents in Sweden. N Engl J Med. 2007, 356, 1009–1019. [Google Scholar] [CrossRef]
- Marzocchi, A.; Saia, F.; Piovaccari, G.; Manari, A.; Aurier, E.; Benassi, A.; et al. Long-term safety and efficacy of drug-eluting stents: two-year results of the REAL (REgistro Angiop-Lastiche dell’Emilia Romagna) multicenter registry. Circulation. 2007, 115, 3181–3188, Epub 2007 Jun 11. [Google Scholar] [CrossRef] [PubMed]
- Daemen, J.; et al. Long-term prognosis after implantation of sirolimus-eluting stents, paclitaxel-eluting stents and bare metal stents. AJC;in press.
- Applegate, R.J.; Sacrinty, M.T.; Kutcher, M.A.; Baki, T.T.; Gandhi, S.K.; Santos, R.M.; et al. Comparison of drug-eluting versus bare metal stents on later frequency of acute myocardial infarction and death. Am J Cardiol. 2007, 99, 333–338. [Google Scholar] [CrossRef] [PubMed]
- Grines, C.L.; Bonow, R.O.; Casey, D.E.; Jr. Gardner, T.J.; Lockhart, P.B.; Moliterno, D.J.; et al. Prevention of premature discontinuation of dual antiplatelet therapy in patients with coronary artery stents. A science advisory from the American Heart Association, American College of Cardiology, Society for Cardiovascular Angiography and Interventions, American College of Surgeons, and American Dental Association, with representation from the American College of Physicians. Circulation. 2007, 115(6), 813–818. [Google Scholar]
- Eisenstein, E.L.; Anstrom, K.J.; Kong, D.F.; Shaw, L.K.; Tuttle, R.H.; Mark, D.B.; et al. Clopidogrel use and long-term clinical outcomes after drug-eluting stent implantation. JAMA. 2007, 297, 159–168. [Google Scholar] [CrossRef]
- Spertus, J.A.; Kettelkamp, R.; Vance, C.; Decker, C.; Jones, P.G.; Rumsfeld, J.S.; et al. Prevalence, predictors, and outcomes of premature discontinuation of thienopyridine therapy after drug-eluting stent placement: results from the PREMIER registry. Circulation. 2006, 113, 2803–2809. [Google Scholar] [CrossRef]
- Wilson, S.H.; Fasseas, P.; Orford, J.L.; Lennon, R.J.; Horlocker, T.; Charnoff, N.E.; et al. Clinical outcome of patients undergoing non-cardiac surgery in the two months following coronary stenting. J Am Coll Cardiol. 2003, 42, 234–240. [Google Scholar] [CrossRef]
- Biondi-Zoccai, G.G.; Lotrionte, M.; Agostoni, P.; Abbate, A.; Fusaro, M.; Burzotta, F.; et al. A systematic review and meta-analysis on the hazards of discontinuing or not adhering to aspirin among 50,279 patients at risk for coronary artery disease. Eur Heart J. 2006, 27, 2667–2674. [Google Scholar] [CrossRef]
- Smith, S.C.; Jr. Feldman, T.E.; Hirshfeld, J.W.; Jr. Jacobs, A.K.; Kern, M.J.; King, S.B.; 3rd et, a.l. ACC/AHA/SCAI 2005 guideline update for percutaneous coronary intervention: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ SCAI Writing Committee to Update 2001 Guidelines for Percutaneous Coronary Intervention). Circulation. 2006, 113, e166–e286. [Google Scholar] [PubMed]
- Pache, J.; Dibra, A.; Mehilli, J.; Dirschinger, J.; Schomig, A.; Kastrati, A. Drug-eluting stents compared with thin-strut bare stents for the reduction of restenosis: a prospective, randomized trial. Eur Heart J. 2005, 26, 1262–1268. [Google Scholar] [CrossRef] [PubMed]
- Rocca, H.P.; Kaiser, C.; Pfisterer, M. Targeted stent use in clinical practice based on evidence from the BAsel Stent Cost Effectiveness Trial (BASKET). Eur Heart J. 2007, 28, 719–725. [Google Scholar] [CrossRef][Green Version]
- Meier, B. (Active) stents are no panacea, a deja-vu. Eur Heart J. 2007, 28, 653–654. [Google Scholar] [CrossRef][Green Version]
- Cook, S.; Wenaweser, P.; Togni, M.; Billinger, M.; Morger, C.; Seiler, C.; et al. Incomplete stent apposition and late stent thrombosis following drug-eluting stent implantation. Circulation. 2007, in press. [Google Scholar] [CrossRef]
- Hoye, A.; Iakovou, I.; Ge, L.; van Mieghem, C.A.; Ong, A.T.; Cosgrave, J.; et al. Long-term outcomes after stenting of bifurcation lesions with the «crush» technique: predictors of an adverse outcome. J Am Coll Cardiol. 2006, 47, 1949–1958. [Google Scholar] [CrossRef]
- Steigen, T.K.; Maeng, M.; Wiseth, R.; Erglis, A.; Kumsars, I.; Narbute, I.; et al. Randomized study on simple versus complex stenting of coronary artery bifurcation lesions: the Nordic bifurcation study. Circulation. 2006, 114, 1955–1961. [Google Scholar] [CrossRef] [PubMed]
- Spaulding, C.; Henry, P.; Teiger, E.; Beatt, K.; Bramucci, E.; Carrie, D.; et al. Sirolimus-eluting versus uncoated stents in acute myocardial infarction. N Engl J Med. 2006, 355, 1093–1104. [Google Scholar] [CrossRef] [PubMed]
- Laarman, G.J.; Suttorp, M.J.; Dirksen, M.T.; van Heerebeek, L.; Kiemeneij, F.; Slagboom, T.; et al. Paclitaxel-eluting versus uncoated stents in primary percutaneous coronary intervention. N Engl J Med. 2006, 355, 1105–1113. [Google Scholar] [CrossRef] [PubMed]
- Calver, A.L.; Blows, L.J.; Harmer, S.; Dawkins, K.D.; Gray, H.H.; Morgan, J.H.; et al. Clopidogrel for prevention of major cardiac events after coronary stent implantation: 30-day and 6-month results in patients with smaller stents. Am Heart J. 2000, 140, 483–491. [Google Scholar] [CrossRef]
- Wenaweser, P.; Dorffler-Melly, J.; Imboden, K.; Windecker, S.; Togni, M.; Meier, B.; et al. Stent thrombosis is associated with an impaired response to antiplatelet therapy. J Am Coll Cardiol. 2005, 45, 1748–1752. [Google Scholar] [CrossRef]



 |
 |
 |
© 2007 by the author. Attribution - Non-Commercial - NoDerivatives 4.0.
Share and Cite
Windecker, S.; Kaiser, C.; Stauffer, J.-C.; Roffi, M.; Pedrazzini, G.; Rickli, H.; Cook, S.; Lüscher, T.F.; Mach, F.; Meier, B.; et al. Nutzen und Risiken von Medikamentös Beschichteten Stents. Cardiovasc. Med. 2007, 10, 412. https://doi.org/10.4414/cvm.2007.01292
Windecker S, Kaiser C, Stauffer J-C, Roffi M, Pedrazzini G, Rickli H, Cook S, Lüscher TF, Mach F, Meier B, et al. Nutzen und Risiken von Medikamentös Beschichteten Stents. Cardiovascular Medicine. 2007; 10(12):412. https://doi.org/10.4414/cvm.2007.01292
Chicago/Turabian StyleWindecker, Stephan, Christoph Kaiser, Jean-Christophe Stauffer, Marco Roffi, Giovanni Pedrazzini, Hans Rickli, Stéphane Cook, Thomas F. Lüscher, François Mach, Bernhard Meier, and et al. 2007. "Nutzen und Risiken von Medikamentös Beschichteten Stents" Cardiovascular Medicine 10, no. 12: 412. https://doi.org/10.4414/cvm.2007.01292
APA StyleWindecker, S., Kaiser, C., Stauffer, J.-C., Roffi, M., Pedrazzini, G., Rickli, H., Cook, S., Lüscher, T. F., Mach, F., Meier, B., Pfisterer, M., Vogt, P., & Jaussi, A. (2007). Nutzen und Risiken von Medikamentös Beschichteten Stents. Cardiovascular Medicine, 10(12), 412. https://doi.org/10.4414/cvm.2007.01292




